阻抗体
阻抗体基本信息
| 中文名 | 阻抗体 | 定 义 | 由多孔材料组成的吸收体,配有两个电导体以连接单臂电桥,从而测定物体的电阻 |
|---|
该方法是把适当的电极安置于制成块状的石膏、尼龙或玻璃纤维中,作为测定水分的感应器(或称感体),然后将其埋置于准备测定的一定深度的土壤中,由于石膏、尼龙或玻璃纤维块是多孔的,有一定的吸水能力,当与土壤接触时,土壤水分含量和吸收体中水分含量会达到平衡。感应器吸水后的电阻与土壤含水量呈一定的关系,利用事先确定的电导与土壤含水量或水吸力关系曲线,通过测定吸收体的电导就可以确定土壤含水量或水吸力。2100433B
阻抗体造价信息
阻抗体常见问题
-
不一定~要具体情况具体分析~单克隆抗体特异性好~多克隆抗体可以识别抗原的多个表位~所以阳性结果的概率多克隆抗体要高于单克隆抗体~
-
j表示矢量。阻抗等于电阻、感抗、容抗三者的矢量和。感抗、容抗方向相反,说以两者矢量和的模就是两个量模的差,公式中表达为j ( XL–XC)。
-
阻抗公式:Z= R+j ( XL–XC)。阻抗Z= R+j ( XL –XC) 。其中R为电阻,XL为感抗,XC为容抗。如果( XL–XC) > 0,称为“感性负载”;反之,如果( XL –XC...
阻抗体文献

 自身抗体检测的质量控制
自身抗体检测的质量控制
自身抗体检测的质量控制

 低压母线阻抗及相保阻抗
低压母线阻抗及相保阻抗
mΩ /m TMY 200 3(40×4)+1(40×4) 0.1119 250 3(40×4)+1(40×4) 0.1119 315 3(50×5)+1(50×5) 0.0728 400 3(63×6.3)+1(63×6.3) 0.0471 500 3(80×6.3)+1(63×6.3) 0.0383 630 3(80×8)+1(63×6.3) 0.031 800 3(100×8)+1(80×6.3) 0.0257 1000 3(125×10)+1(80×8) 0.0177 1250 3*2(100×10)+1(100× 10) 0.0109 1600 3*2(125×10)+1(125× 10) 0.0089 2000 3*2(125×10)+1(125× 10) 0.0089 变压器容 量KVA 母线规格 mm Rm D=150 D=250 D=350 mΩ /m mΩ /m mΩ
还有一种需要纯化抗体的试验,是从多克隆抗血清中分离抗原特异性抗体。多克隆血清中含有复杂多样的抗体,它不仅含有针对免疫原产生的抗体,还有血清的全部抗体。出于特定目的的需要,必须将抗原的特异性抗体分离出来。例如使用抗肽抗体时,需要分离出特异性识别肽段的抗体。通过纯化能获得特异性很高的抗体。纯化抗体的另一用途是降低本底。几乎在所有技术中,使用纯化抗体都能降低非特异性本底。产生这种效果主要是因为一方面能去除引起实验误差的污染蛋白,另一方面能精确控制实验中产生阳性信号的抗体量。使用纯化抗体不会使本底增加,因此纯化抗体可以作为所有免疫化学实验中降低本底的基本手段。
抗体的纯化通常是浓缩抗体的最简单方法。任何来源的抗体可以用蛋白A或蛋白G的纯化方法来浓缩。
尽管纯化抗体的方法较多,建议用蛋白A或蛋白G微球纯化法作为最常用的方法。这种方法效率高,能为常用的实验方法提供足够纯化的抗体,而且随着商品化的蛋白A和蛋白G基质的出现,能将任何来源的抗体纯化。抗体的纯化也可采用传统的色谱法,在某些情况下非常有用。这些方法包括DEAE离子交换色谱法、硫酸铵沉淀法及其他方法。但是用蛋白G或蛋白A亲和柱法纯化较其他方法简单,并且纯化效果是其他方法的数倍。


骆驼体内存在天然的缺失轻链的重链抗体,克隆其可变区可以得到只有重链可变区组成的单域抗体,称为VHH(Variable domain of heavy chain of heavy chain antibody),也称为纳米抗体(nanobody, a single domain antibody),它是最小的功能性抗原结合片段。和普通抗体相比,纳米抗体分子量小,结构简单,易于进行基因改造,体积小,抗原特异性好,组织穿透力强,稳定性高,在疾病的诊断及治疗方面有广阔的应用前景。本文就纳米抗体的结构、建库、淘选及应用方面做简要介绍。


1. 纳米抗体与普通抗体的结构及功能比较
感染或者免疫过的单峰骆驼的免疫反应会产生普通的及仅有重链的抗体,这两种类型的抗体均有与抗原结合的能力。重链抗体缺少普通抗体所有的CH1区域,且CDR1和CDR3要比VH长,这在一定程度上弥补了缺失轻链造成的抗原结合力下降的不足。二者结构上差异如下图所示:
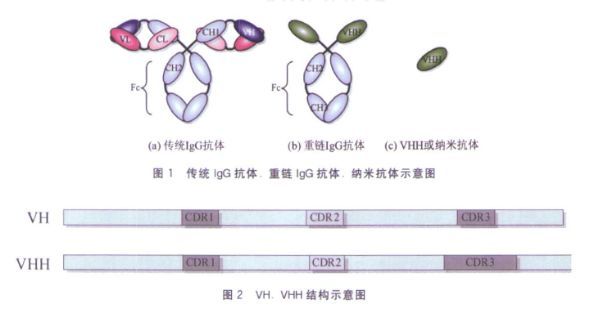
普通的免疫球蛋白的基本结构是分子量为150 k Da的四聚体多肽,由两对相同的重链(50 k Da)和轻链(25k Da)多肽组成,二者由链间的二硫键链接。轻链由N端的可变区(VL)和C端的一个保守的区域(CL)构成。重链由四个或五个结构域组成:N端的可变区(VH),紧接着三至四个恒定的区域(CH1,CH2,CH3,可能CH4)。免疫球蛋白形成Y型或T型结构,两个抗原结合区域通过CH1及CH2间的柔性铰链区连接在一起,连到负责起效应的具有保守结构的FC区域。在哺乳动物中这种免疫球蛋白的结构相对比较保守。
抗体的FC区域由重链的CH2及CH3构成,介导抗体依赖的细胞毒效应(ADCC)及补体依赖的细胞毒效应(CDC)。 抗体的N端,配对的VH及VL形成抗体的抗原结合位点(FV),在轻、重链每个可变区中存在三个氨基酸长度及序列高度变异的区域,简称为CDR1,CDR2,CDR3, 这三个区域被四个序列相对保守的骨架区分隔开(FR1,FR2,FR3,FR4)。轻重链高变区通过非共价结合聚集成簇,形成大的界面与抗原结合,也即为抗体决定簇。这些超变的区域折叠成一些经典的loop结构。重链可变区的CDR3在长度及氨基酸组成上最多变,因此结构也最难预测。
骆驼科血清中有普通的IgG1, 及重链抗体IgG2(约10 k Da)及IgG3(约12 k Da)。由于3’端CH1外显子处剪切信号的点突变导致的可变剪接,造成重链抗体缺少能与轻链结合的CH1区域。IgG1分为IgG1a (铰链区19个氨基酸) 和IgG1b (铰链区12个氨基酸) IgG2分为IgG2a (铰链区35个氨基酸) IgG2b (铰链区29个氨基酸)IgG2c (铰链区15个氨基酸)。IgG3 (铰链区12个氨基酸)大约15 k Da, 分子量小,但拥有完整的抗原结合位点。
在序列上,脊椎动物中,普通抗体和纳米抗体序列大部分相同,但存在五个保守位点氨基酸差异。Leu12Ser(即12位在VH中常为Leu, 而在VHH中此位常为Ser), Val42Phe/Tyr, Gly49Glu, Leu50Arg/Cys, 和Trp52Gly(不是非常保守)。VH中42,49,50,52这四个位点主要参与与VL 作用,多为疏水的氨基酸,但在VHH中变成了亲水的氨基酸,这种序列的改变增加了纳米抗体的水溶性,减少了抗体的聚合性,也直接导致了VHH不能够结合轻链。
在结构上,CDR1由于突变热点的存在(28位和30位),导致VHH向N端延长。VHH的CDR3 也较VH的长,大约为18个氨基酸,而人的VH常为14,鼠11个氨基酸。纳米抗体仅有一个结构域,不含传统的连接肽序列。除了域内保守的二硫键,VHH CDR3中的CYS还可以与CDR1或FR2中的CYS形成二硫键,这些增加的序列和loop结构扩大了抗体与抗原结合的面积以及抗体的多样性,同时导致其结构非常稳定,能够耐受高温及苛刻的极端环境。其次,纳米抗体没有传统的Fc段,从而避免了Fc段引起的补体反应。
纳米抗体易于进行基因操作,从而形成单价、双价、双特异及多价抗体,同时也能形成融合蛋白进行靶向治疗。如下图所示。

纳米抗体对人体免疫原性较弱,相容性好。 比较VH germline 序列及单峰骆驼germline 序列,前者大约50种,后者大约40种。骆驼的VHH胚系基因序列和人类VH3家族序列高度同源,因此对VHH进行人源化比较简单。
纳米抗体分子量小,结构简单,并由单一的基因编码,因此在噬菌体、细菌及酵母中能大量表达。纳米抗体具有强而快的穿透能力,利于它们进入实体瘤中发挥作用,同时由于其能穿透血脑屏障,为脑部给药提供了新方法。
2. 纳米抗体库的构建
鉴于VHH 与VH的差异主要在于CH1区域的缺失,因此,建免疫和天然库的工作重点在于从IgG中分离出缺少CH1的抗体。可以通过一步或者二步PCR扩增来实现。PCR的关键在于利用抗体骨架区的保守核苷酸序列来设计PCR引物。对于一步法PCR,可以扩增从FR1到铰链区序列,同时在引物上引入酶切位点。对于两步法PCR,第一步PCR: Leader sequence to CH2的保守区。会产生两种产物,VH(大约 850-900bp)及 VHH (大约550-600bp)。从PCR产物中分离出VHH。第二步 PCR: 以第一步PCR产物为模板,应用可变区的FR1到FR4的保守区设计引物,扩增出VHH序列,同时也引入酶切位点方便下一步实验。扩增出的抗体序列连接到载体上,其余的步骤同普通的构建抗体库的过程。具体流程见图三。一般纳米抗体库容量可以比较容易达到10e8或10e9,多样性大于95%。同时由于VHH只有一个可变区,库容在10e6时也能筛选到特异性抗体。但是在普通的抗体Fab 或者ScFv库中,需要库容足够大才能更容易地筛选得到抗体。
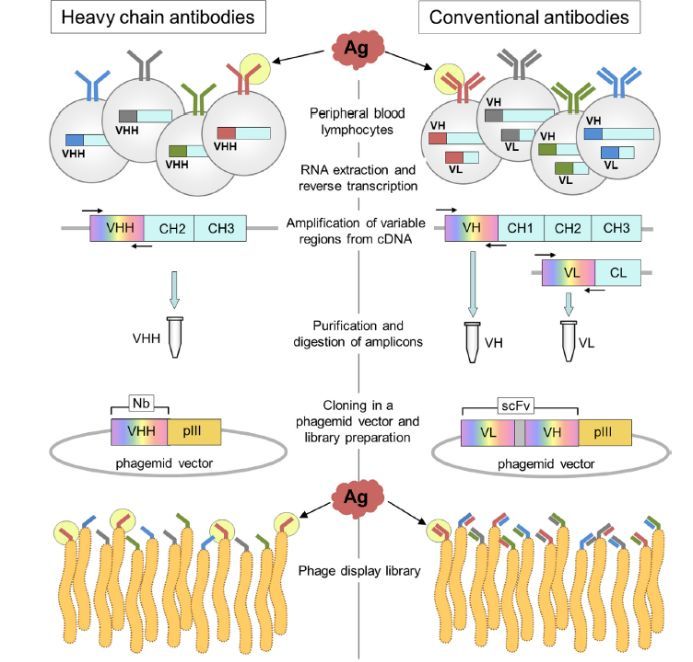
图三:纳米抗体库的构建及纳米抗体的淘选
3. 纳米抗体的淘选
纳米抗体的淘选和普通抗体的淘选比较类似,可以通过噬菌体展示的方法,淘选到抗原特异性抗体。将普通抗原固定在固相支持的载体上,经过封闭,结合,洗脱,扩增等阶段富集抗原特异性抗体。一般通过2-3轮淘选即可筛选到特异性抗体。同时也可以在液相中淘选,利用SA包被的磁珠与生物素标记的抗原间的特异性结合,也经过封闭,结合,洗脱,扩增等步骤得到抗原特异性抗体。除了普通的蛋白淘选,也可以用表达特异性抗原的细胞进行淘选,大体步骤也同蛋白淘选。
为了提高淘选得到蛋白的亲和力,在每轮淘选时可以连续降低抗原的浓度或者细胞的量,同时逐步增加洗涤的次数。在封闭时加入一些阴性对照蛋白或者细胞能提高淘选到的抗体的特异性。
淘选得到的抗体依载体的不同,可以表达在上清或者细胞周质里,通过ELISA或者FACS验证抗体与抗原的结合能力。为了下游动物实验的进行,需要筛选到人、鼠、猴三阳的抗体。
4. 纳米抗体的应用
纳米抗体能用于构建多重不同类型的分子结构,在医学诊断和治疗上实用性较高。例如可以构建成双功能抗体或双特异性抗体进行疾病的靶向治疗。双特异性抗体可以识别一个靶抗原的相邻两个位点,获得对抗原的高亲和性,也可以识别不同的抗原,如肿瘤细胞和免疫细胞表面的抗原,达到治愈疾病的目的。与普通的双特异性抗体相比,它们分子量小,水溶性及稳定性高,表达量也普遍较高。
通过基因改造,纳米抗体可以形成多聚体,大大提高了抗体与抗原的结合能力。通过基因工程形成纳米抗体融合蛋白可以带上酶或者毒素,融合蛋白在组织穿透,清除速度及稳定性上比普通抗体更有优势,可以用于低浓度抗原的检测。
由于纳米抗体结构稳定,也可应用于蛋白晶体结构研究中。纳米抗体形成的蛋白复合物能稳定抗原,保持其晶体结构,是研究不稳定的蛋白良好载体。
纳米抗体也能作为胞内抗体发挥作用。大部分抗体在细胞内没有功能,因为在细胞质还原环境中不能形成二硫化合物,或者靶向亚细胞部位比较困难,但纳米抗体通常比较稳定,甚至在胞质中能维持其抗原结合能力。
5. 小结
纳米抗体发展到现在,已经拥有广泛的应用价值,由于分子量小,结构稳定,容易进行基因改造,生产成本低,易于进行大规模生产,因此,纳米抗体在疾病治疗和诊断及肿瘤的靶向诊断和治疗中具有很大的发展机遇。
免疫亲和纯化是另一种可能需要纯化抗体的技术。在这一技术中,抗体共价交联到一固相基质上,如交连的琼脂糖或聚丙烯酰胺微球。常用的方法是,先将抗体纯化,然后连接到通过化学方法激活而具有结合位点的微球上。此时,抗体的纯化对实验的成功至关重要。
- 相关百科
- 相关知识
- 相关专栏
- 阻抗式调压室
- 阻抗模
- 阻抗电压百分比
- 阻抗电压
- 阻抗继电器动作行为分析
- 阻桩
- 阻水比
- 阻燃木材燃烧性能试验—火传播试验方法
- 阻燃木材燃烧性能试验方法
- 阻燃材料及应用技术
- 阻燃ABS
- 阿什河街65号住宅楼平面图
- 阿什河街65号住宅楼旧貌
- 阿克太
- 阿克苏众之鑫金属制品有限责任公司
- 阿克苏华水立通管道安装维修有限责任公司
- 和利时推出LK431通道隔离热电阻型模拟量输入模块
- 基于RS-485总线主从分布式电阻炉温度群控系统
- 基于ANSYS二次开发开关磁阻电机电磁场分析软件
- 基于10kV小电阻接地系统架空线路接地故障指示器
- 接地电阻国家标准
- 利用高密度电阻率法进行断层破碎带探查数值模拟方法
- 建筑外立面开口火溢流垂直扩散阻隔技术数值模拟
- 晶闸管移相触发组合模块在箱式电阻炉温控系统中应用
- 氯盐阻锈型防冻剂中引气组分掺量对混凝土性能影响
- 具有优异低温韧性APIX80级别电阻焊接管线钢
- 技术交底北京建工集团通用硬质阻燃PVC管暗敷
- 基于电阻率法膨胀土吸水膨胀过程中结构变化定量
- 极低屈服点钢阻尼耗能减震器在钢结构建筑中应用技术
- 山东省电气工程师基础电阻考试试卷
- 安徽职业院校技能大赛高职组鸡新城疫抗体水平测
- 钻孔灌注桩成孔质量电阻率法试验检测作业指导书