增烃水煤气
增烃水煤气基本信息
| 中文名 | 增烃水煤气 | 外文名 | carburreted water gas |
|---|---|---|---|
| 相关领域 | 化石能源工程 | 所属类型 | 专业术语 |
亦称兰焰水煤气。是一种比较清洁的低级燃料气,主要用于工业中对材料加热以及用作炉子的燃料。水煤气是使过热蒸汽通过红热的焦炭床而产生出来的。蒸汽部分地使碳氧化形成一氧化碳,而它本身则还原为氢气。水煤气的主要成分是一氧化碳(40至45%)和氢(45至51%),其比例视反应条件而定。水煤气还含一些二氧化碳、怎和微量的甲烷。一氧化碳和氢都是可燃的,但此混合气的热值不很高,约为350英热单位/英尺(13.0兆焦耳/米)。
蒸汽与焦炭之间的反应要吸热,使焦炭床的温度急剧下降。因此,焦炭床要用吹气再加热。这样就使过程成为断续的一一焦炭再加热吹气的一分钟,再送蒸汽三分钟。
吹气阶段产生的水煤气常常经烟道排出而浪废掉。但是,如果焦炭床足够厚,吸气阶段就可产生出叫作发生炉煤气的一氧化碳和氮的混合气。由于一氧化碳也是可燃的,可以与水煤气相混合,这样主要由一氧化碳、氢和氮组成的混合气叫作半水煤气。
增烃水煤气造价信息
生产水煤气一般用焦炭作燃料,因为焦炭的碳含量和清洁度都很高。也有用无烟煤、烟煤以及煤和焦炭的混合物的,而且较为成功,但是整个操作效率要有些降低。
水煤气燃烧时带有明亮的蓝火焰,所以称为“蓝水煤气”。水煤气用于许多化学工程,可以为合成工艺的基本燃气,但是不宜用作家庭燃料,除非用热解的燃料油增烃,制得所谓的增烃水煤气。
焦炭制得的水煤气然烧时不带光焰,而增烃水煤气燃烧时具有很强的光焰,不过,这两种水煤气的燃烧速度超过其它任何广泛使用的燃气;增烃水煤气的燃烧速度实际上与焦炉煤气相当。水煤气的比重比天然气的稍小一点,但是比焦炉煤气要大;增烃水气比重比天然气大,但是比发生炉煤气要小。蓝水煤气和增烃水煤气两者的理论火焰温度很,分别约为2020°C和2050°C,超过通常使用的所有其它工业燃气。这两种水煤气都具有相当宽的爆炸范围。
使蒸汽通过热焦炭而制成的水煤气,为提高水煤气浓度还使粗柴油同时通过焦炭。最终产品增烃水煤气的热值约500英热单位/立方英尺(18.7兆焦耳/立方米)。增烃水煤气由美国早在上世纪发明的方法生产,而且是用石油产品生产煤气的第一种应用场合。
增烃水煤气常见问题
-
水煤气其实就是水蒸气和灼热的焦炭反应。水蒸气和灼热的焦炭在高温的条件下反应生成氢气和:H2O+C=高温=H2+CO(反应物的水是以水蒸气气态的形式存在,所以生成物的气体不需要标气体符号)。然后生成的氢...
-
水煤气行业的“工业革命” ——洛阳豫燃”两步法水煤气制造工艺” 撰稿 张金辉 肖继平 指导 陶予敏 迈入二十一世纪,人类不得不承认,伴随着新科技,新文明的到来.能源危机的红灯频频亮起。石油、煤炭、天然...
-
套钢管敷设子目。
增烃水煤气文献

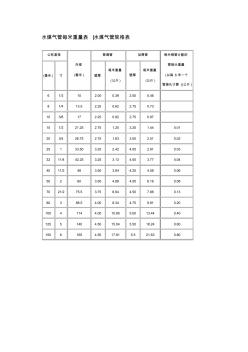 水煤气钢管表
水煤气钢管表
水煤气管每米重量表 |水煤气管规格表 公称直径 外径 (毫米 ) 普通管 加厚管 每米钢管分配的 管接头重量 (以每 6米一个 管接头计算 )(公斤 ) (毫米 ) 寸 壁厚 每米重量 (公斤 ) 壁厚 每米重量 (公斤 ) 6 1/3 10 2.00 0.39 2.50 0.46 8 1/4 13.5 2.25 0.62 2.75 0.73 10 3/8 17 2.25 0.82 2.75 0.97 15 1/2 21.25 2.75 1.25 3.25 1.44 0.01 20 3/4 26.75 2.75 1.63 3.50 2.01 0.02 25 1 33.50 3.25 2.42 4.00 2.91 0.03 32 11/4 42.25 3.25 3.13 4.00 3.77 0.04 40 11/2 48 3.50 3.84 4.25 4.58 0.06

 焦炉煤气配半水煤气生产合成氨扩能改造
焦炉煤气配半水煤气生产合成氨扩能改造
分析了山西丰喜华瑞煤化工公司焦炉煤气配半水煤气生产合成氨18-30项目生产工艺流程,结合周边焦化厂富余焦炉煤气的实际供应情况,对原工艺流程进行优化,改造方案为:增加变压吸附提氢工序、强化甲烷转化工艺条件、增加部分设备等。通过改造,可使合成氨生产能力由18万t/a提高到24万t/a、尿素生产能力由30万t/a提高到40万t/a,取得较好的经济效益和社会效益。
炔烃是一类有机化合物,属于不饱和烃。其官能团为碳碳三键(-C≡C-)。直链单炔烃的通式CnH2n-2,其中n为≥2的正整数。简单的炔烃化合物有乙炔(C2H2)、丙炔(C3H4)等。炔烃原来也被叫做电石气,电石气通常也被用来特指炔烃中最简单的乙炔。
“炔”字是新造字,左边的火取自“碳”字,表示可以燃烧;右边的夬取自“缺”字,表示氢原子数和化合价比烯烃更加缺少,意味着炔是烷(完整)和烯(稀少)的不饱和衍生物。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些。不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。 因为炔在燃烧时放出大量的热,炔又常被用来做焊接时的原料。
近几年来,正在开发高温气冷堆的技术,用氦为热载体将核反应热转送至气化炉作为热源,以生产水煤气。
炔烃的一般制备是通过邻二卤化烷烃的脱卤化氢作用,也可以通过金属炔化合物与一级卤化烷反应制得。在Fritsch-Buttenberg-Wiechell重排中,炔烃又溴化乙烯基起始制得。
炔烃也可以由醛通过Corey-Fuchs反应制得,亦可以通过Seyferth-Gilbert同素化制得。
乙炔制作用煤或石油作原料,是生产乙炔的两种主要途径。随着天然气化学工业的发展,天然气即将成为乙炔的主要来源。
炔烃电弧法
甲烷在1500℃电弧中经极短时间(0.1~0.01s)加热,裂解成乙炔,即:
2CH4→C2H2 3H2,ΔH=397.4KJ/mol
由于乙炔在高温很快分解成碳,故反应气须用水很快地冷却,乙炔产率约15%,改用气流冷却反应气,可提高乙炔产率达25%~30%。裂解气中还含有乙烯、氢和碳尘。这个方法的总特点是原料非常便宜,在天然气丰富的地区采用这个方法是比较经济的。石脑油也可用此方法生产乙炔。
炔烃电石法
用焦炭和氧化钙经电弧加热至2200℃,制成碳化钙(CaC2),它再与水反应,生成乙炔和氢氧化钙:
CaO 3C<—2200℃—>CaC2 CO,ΔH=460kJ/mol
CaC2 2H2O——>C2H2 Ca(OH)2
此法成本较高,除少数国家外,均不用此法。
炔烃等离子法
用石油和极热的氢气一起热裂制备乙炔,即把氢气在3500~4000℃的电弧中加热,然后部分等离子化的等离子体氢(正负离子相等)于电弧加热器出口的分离反应室中与气体的或气化了的石油气反应,生成的产物有:乙炔、乙烯(二者的总产率在70%以上)以及甲烷和氢气。
乙炔过去是非常重要的有机合成原料,由于乙炔的生产成本相当高,以乙炔为原料生产化学品的路线逐渐被以其他化合物(特别是乙烯、丙烯)为原料的路线所取代。
纯的乙炔是带有乙醚气味的气体,具有麻醉作用,燃烧时火焰明亮,可用以照明。工业乙炔不好闻气味是由于含有硫化氢、磷化氢、以及有机磷、硫化合物等杂质引起的。与乙烯、乙烷不同,乙炔在水中具有一定的溶解度,但易溶于丙酮。液化乙炔经碰撞、加热可发生剧烈爆炸,乙炔与空气混合、当它的含量达到3~70%时,会剧烈爆炸。商业上为安全地处理乙炔,把它装入钢瓶中,瓶内装有多孔材料,如硅藻土、浮石或木炭,再装入丙酮。丙酮在常压下,约可溶解相当于它体积25倍的乙炔,而在1.2MPa下可溶解相当其体积300倍的乙炔。乙炔和氧气混合燃烧,可产生2800℃的高温,用以焊接或切割钢铁及其他金属。
- 相关百科
- 相关知识
- 相关专栏
- 增量计算法
- 增长型永续年金
- 墨沟石灰岩
- 墨轮打码机
- 墨辊
- 壁画取暖器
- 壁虎(英国)有限公司
- 壁面热流
- 壕猪刺
- 壤塘县发展和改革委员会
- 壤塘县建筑安装装饰工程公司
- 士兴国际集团
- 声光材料
- 声卡芯片厂家
- 声威W001
- 声子晶体型压电换能器的设计原理和实验研究
- 桃山水库二期工程增容与兴凯湖调水的关系
- 增设钢牛腿在连续独柱墩桥梁抗倾覆加固设计中的应用
- 增效剂在水工高性能混凝土中增效机理及其应用
- 云南绿水河二级电站4号水轮机增容技术改造效果分析
- 增城区农村小型工程建设项目施工企业库房屋建筑工程
- 增粘剂PN759在橡胶与钢丝帘线粘合中的应用
- 增韧双马来酰亚胺树脂及其玻璃布层压板的制备与性能
- 中国热水管道增压泵价格行业十大立式自吸泵品牌首选
- 增强水泥(GRC)聚苯复合板外墙保温施工工艺标准
- 增强整体效益促进持续发展:谈建筑热环境改善与节能
- 增大截面与CFRP复合加固素混凝土短圆柱试验
- 增设Ⅱ型电动轮汽车主发电机磁场电流监测信号的构思
- 增建二线铁路线间距偏小地段石方爆破施工工艺
- 增强水文与水资源工程专业本科生毕业实习效果的思考
- 营改增背景下建筑企业财务管理所受影响及应对策略
- 应用新型高性能水轮机转轮对老电站水电机组增容改造