亚硝酸制备方法

亚硝酸制备方法
用亚硝酸钠制取。 化学式NaNO2。亚硝酸仅存在于稀的水溶液中,是一种弱酸,不稳定,易分解成NO2和NO,也能发生如下歧化反应: 3HNO2─→HNO3+2NO+H2O
在亚硝酸中氮原子的氧化数是+3,是一种中间氧化态,因此,亚硝酸既具有氧化性,又具有还原性,而氧化性比还原性更为突出。例如,它在水溶液中能将I-离子氧化为单质碘:
2HNO2+2I-+2H+─→I2+2NO+2H2O
这个反应可用于分析测定。在多数的情况下,亚硝酸可还原成氧化氮NO,也可还原成氧化二氮N2O、氮、胲NH2OH或氨NH3。它被氧化时,即成为硝酸。
将二氧化氮和氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液:
NO2+NO+H2O─→2HNO2
在亚硝酸盐溶液中加入酸,也可得到亚硝酸的溶液:
NaNO2+HCl─→HNO2+NaCl
亚硝酸在工业上用于有机合成,使胺类转变成重氮化合物,从而制备偶氮染料。
亚硝酸有顺式和反式之分,其中反式亚硝酸比顺式亚硝酸更稳定。
亚硝酸造价信息

亚硝酸化学性质
分子式:HNO2 分子量:47.013 键长:N—OH为143pm,N—O为118pm。 键角:HON为102°,∠ONO为111°。
化学式HNO2。亚硝酸仅存在于稀的水溶液中,是一种弱酸,不稳定,易分解成NO2和NO,也能发生如下歧化反应:
3HNO2─→HNO3+2NO↑+H2O
在亚硝酸中氮原子的氧化数是+3,是一种中间氧化态,因此,亚硝酸既具有氧化性,又具有还原性,而氧化性比还原性更为突出。例如,它在水溶液中能将I-离子氧化为单质碘:
2HNO2+2I-+2H+─→I2+2NO↑+2H2O
这个反应可用于分析测定。在多数的情况下,亚硝酸可还原成一氧化氮NO,也可还原成氧化二氮N2O、氮、胲NH2OH或氨NH3。它被氧化时,即成为硝酸。 将二氧化氮和氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液:
NO2+NO+H2O─→2HNO2
在亚硝酸盐溶液中加入酸,也可得到亚硝酸的溶液:
NaNO2+HCl─→HNO2+NaCl
亚硝酸也可用NO与O2与水反应制得:
4NO+O2+2H2O===4HNO2
此反应可以理解为NO与O2生成N2O3,N2O3再与水反应形成亚硝酸
亚硝酸在工业上用于有机合成,使胺类转变成重氮化合物,从而制备偶氮染料。
分解产物
硝酸盐分解的产物可以是:
1、亚硝酸盐和氧气(碱金属和碱土金属的硝酸盐);
2、金属氧化物和氮氧化物(镁和铜之间的硝酸盐);
3、金属单质(铜后金属硝酸盐)。
化学反应
加热急速分解为一氧化氮(NO),二氧化氮(NO2)和水
2HNO2==H2O+NO↑+NO2↑
脂肪伯胺与亚硝酸反应生成相应的醇,并放出氮气。 芳香伯胺与亚硝酸在低温和酸性条件下发生重氮化反应,产物重氮盐不稳定,遇热分解成为酚与氮气。 脂肪仲胺和芳香仲胺与亚硝酸反应生成N-亚硝基胺,其是不溶于水的黄色油状物或固体。 脂肪叔胺和亚硝酸只形成不稳定的盐。 芳香叔胺如N,N-二甲苯胺在酸性条件下可与亚硝酸反应生成4-亚硝基-N,N-二甲苯胺,其为绿色沉淀。
亚硝酸仅存在于稀的水溶液中,是一种弱酸,由金属离子和硝酸根离子组成的化合物,硝酸盐极易溶于水,所以溶液中硝酸根不与其他阳离子反应,硝酸盐大量存在于自然界中,主要来源是固氮菌固氮形成,或在闪电的高温下空气中的氮气与氧气直接化合成氮氧化物,溶于雨水形成硝酸,在与地面的矿物反应生成硝酸盐。
重要的有亚硝酸钠、亚硝酸钾等。大多是晶体。有致癌作用,需注意安全。用于制染料、药物,并用作试剂。可由硝酸盐加热或与金属铅共熔而制得。
亚硝酸制备方法常见问题
-
硝酸钠的制备方法:一、酸碱反应:氢氧化钠溶液和稀硝酸反应:NaOH+HNO3=NaNO3+H2O二、酸和金属氧化物反应:稀硝酸和氧化钠反应:Na2O+2HNO3=2NaNO3+H2O三、盐和酸反应:碳...
-
世界上90%的咔唑是从煤焦油中得到的 ;也可由邻氨基联苯合成,然后用二重结晶精制。(1)合成法:以邻氨基二苯胺为原料,经亚硝酸处理,制得1-苯基-1,2,3-苯并,加热后,失去氮而生成咔唑。(2)法:...
-
①将定量的水加入四口烧瓶中,升温至60~0,开动搅拌器,然后一次性加入聚乙烯醇(1799)、聚丙烯酰胺、乳化剂、增稠剂和自来水。 2 ②继续升温至90~95℃,保持温度1h以上,.直至聚乙烯醇(179...
亚硝酸危害处理
硝酸盐对人体健康的损害不亚于农药。因为硝酸盐不仅容易诱发糖尿病,对肾脏造成的损害也十分严重。肾脏是过滤血液和废物、排泄水分及盐分的重要器官,如果人们摄取了高浓度的硝酸盐,肾脏的负担加重,容易引起溶血性贫血。除此之外,留存在蔬菜内的硝酸盐在酶和细菌的作用下,被还原成亚硝酸 盐,进而与人体内的蛋白质类物质结合,生成致癌性极强的亚硝酸胺类物质。
慎重选购:消费者应少购温室里生长的“反季节蔬菜”。这种蔬菜营养低、口味差,硝酸盐含量高,过多食用有损健康。应注意选购本地生长的蔬菜。一般来讲,经长途贩运而来的蔬菜,所含的硝酸盐往往会成倍增多,要多食根茎和瓜果类蔬菜。
减害处理:对不放心的蔬菜,在食用前应作一定的减害处理,如日晒、漂洗和浸泡等。这些方法是降低菜体内残留硝酸盐的有效方法。
科学食用:所购蔬菜不宜长时间存放,多吃熟菜,含硝酸盐量高的蔬菜应少作凉拌或半生不熟地吃。蔬菜制成熟菜后应尽快吃完,不宜隔夜存放。进食时要充分咀嚼,因为唾液也能使亚硝胺丧失对人体细胞的突变作用。
亚硝酸制备方法文献

 亚硝酸盐含量测定方法
亚硝酸盐含量测定方法
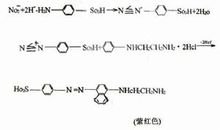
亚硝酸盐测定 1、原理 样品经沉淀蛋白质、 除去脂肪后,在弱酸条件下亚硝酸盐与对氨 基苯磺酸重氮化后,再与 N-1-萘基乙二胺偶合形成紫红色染料, 与标准比较定量。 2、试剂 实验用水为蒸馏水,试剂不加说明者,均为分析纯试剂。 2.1 氯化铵缓冲液: 1L 容量瓶中加入 500mL 水,准确加入 20.0mL 盐酸,振荡混匀,准确加入 50mL 氢氧化铵,用水稀释至刻 度。必要时用稀盐酸和稀氢氧化铵调试至 pH9.6~9.7。 2.2 硫酸锌溶液 (0.42mol/L):称取 120g硫酸锌 (ZnSO4·7H2O), 用水溶解,并稀释至 1L。 2.3 氢氧化钠溶液 (20g/L):称取 20g 氢氧化钠用水溶解,稀释 至 1L。 2.4 对氨基苯磺酸溶液:称取 10g 对氨基苯磺酸,溶于 700mL 水和 300mL 冰乙酸中,置棕色瓶中混匀,室温保存。 2.5 N-1-萘基乙二胺溶液

 一种耐酸砖的制备方法
一种耐酸砖的制备方法
本文利用高岭土、石英砂、耐火材料废料、钾长石和碳酸钡为原料制备出了一种性能良好的耐酸砖。通过试验证明,碳酸钡的加入可以有效地提高耐酸砖的耐酸性能。
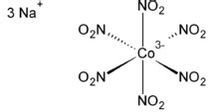
亚硝酸钴钠理化性质
亚硝酸钴钠是深橘黄色的粉末,易溶于水。
亚硝酸钴钠能被强酸、强碱破坏。其水溶液不稳定,常温下即可缓慢分解。[Co(NO2)6]3-离子(亚硝酸钴(III)离子)与乙酰丙酮作用,仅有四个硝基能被取代。反应产物具有反式结构,由于反位效应的影响,一个配位硝基很容易被氨(胺)取代。
由甲醇与亚硝酸钠在硫酸存在下反应而得。
危险性类别:
侵入途径:
健康危害: 本品属亚硝酸酯类,亚硝酸酯类的主要作用是使血管扩张,引起血压下降及心动过速。大剂量可引起高铁血红蛋白血症。
环境危害:
燃爆危险: 本品易燃。
第四部分:急救措施 回目录
皮肤接触: 脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
眼睛接触: 提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入: 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入: 饮足量温水,催吐。就医。
第五部分:消防措施
危险特性: 易燃,遇明火、高热易引起燃烧,并放出有毒气体。
有害燃烧产物: 一氧化碳、二氧化碳、氧化氮。
灭火方法: 喷水保持火场容器冷却,直至灭火结束。消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。灭火剂:泡沫、二氧化碳、干粉、砂土。
第六部分:泄漏应急处理
应急处理: 迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防毒服。尽可能切断泄漏源。防止流入下水道、排洪沟等限制性空间。小量泄漏:用砂土、蛭石或其它惰性材料吸收。大量泄漏:构筑围堤或挖坑收容。用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
第七部分:操作处置与储存
操作注意事项: 严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(半面罩),戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶耐油手套。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。防止蒸气泄漏到工作场所空气中。避免与氧化剂接触。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项: 储存于阴凉、干燥、通风良好的库房。远离火种、热源。避光保存。库温不宜超过30℃。保持容器密封。应与氧化剂分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
第八部分:接触控制/个体防护
职业接触限值
中国MAC(mg/m3): 未制定标准
前苏联MAC(mg/m3): 未制定标准
TLVTN: 未制定标准
TLVWN: 未制定标准
监测方法:
工程控制: 严加密闭,提供充分的局部排风和全面通风。
呼吸系统防护: 可能接触其蒸气时,应该佩戴自吸过滤式防毒面具(半面罩)。紧急事态抢救或撤离时,建议佩戴氧气呼吸器。
眼睛防护: 戴化学安全防护眼镜。
身体防护: 穿防毒物渗透工作服。
手防护: 戴橡胶耐油手套。
其他防护: 工作现场禁止吸烟、进食和饮水。特别注意眼和呼吸道的防护。工作完毕,彻底清洗。单独存放被毒物污染的衣服,洗后备用。
第九部分:理化特性
主要成分: 纯品
外观与性状: 无色液体。
pH:
熔点(℃): 无资料
沸点(℃): 46~48
相对密度(水=1): 0.89
相对蒸气密度(空气=1): 无资料
饱和蒸气压(kPa): 无资料
燃烧热(kJ/mol): 无资料
临界温度(℃): 无资料
临界压力(MPa): 无资料
辛醇/水分配系数的对数值: 无资料
闪点(℃): <10
引燃温度(℃): 无资料
爆炸上限%(V/V): 无资料
爆炸下限%(V/V): 无资料
溶解性: 微溶于水,溶于乙醇、乙醚。
主要用途: 用于有机合成, 用作溶剂。
其它理化性质:
第十部分:稳定性和反应活性
稳定性:
禁配物: 强氧化剂。
避免接触的条件: 潮湿空气、光照可分解。
聚合危害:
分解产物:
第十一部分:毒理学资料
急性毒性: LD50:无资料
LC50:无资料
亚急性和慢性毒性:
刺激性:
致敏性:
致突变性:
致畸性:
致癌性:
第十二部分:生态学资料
生态毒理毒性:
生物降解性:
非生物降解性:
生物富集或生物积累性:
其它有害作用: 无资料。
第十三部分:废弃处置
废弃物性质:
废弃处置方法: 处置前应参阅国家和地方有关法规。建议用焚烧法处置。焚烧炉排出的氮氧化物通过洗涤器除去。
废弃注意事项:
第十四部分:运输信息
危险货物编号: 32153
UN编号: 无资料
包装标志:
包装类别: O52
包装方法: 小开口钢桶;安瓿瓶外普通木箱;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱。
运输注意事项: 铁路运输,医用安瓿瓶包装,每盒 5×0.2 毫升,每箱 300盒时,可按普通货物运输。运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。夏季最好早晚运输。运输时所用的槽(罐)车应有接地链,槽内可设孔隔板以减少震荡产生静电。严禁与氧化剂等混装混运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火种、热源、高温区。装运该物品的车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。铁路运输时要禁止溜放。严禁用木船、水泥船散装运输。
第十五部分:法规信息
法规信息 化学危险物品安全管理条例 (1987年2月17日国务院发布),化学危险物品安全管理条例实施细则 (化劳发[1992] 677号),工作场所安全使用化学品规定 ([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用危险化学品的分类及标志 (GB 13690-92)将该物质划为第3.2 类中闪点易燃液体。
- 相关百科
- 相关知识
- 相关专栏
- 超级前档玻璃
- 均相沉淀
- 氢气检测仪
- 涂层烘干机
- 福瑞达超级前挡玻璃
- 江山金闰门业
- 合成磨削液
- 三价铬钝化
- 蒸汽发蓝炉
- 玻璃切削液
- 好儿郎实木复合门
- α-松油烯
- 铁达尼克号
- 硝酸根
- 跃进号货轮
- 熔盐加热炉
- 有软弱下卧层时确定天然地基上基础底面积的简便方法
- 以水利项目为例分析社会稳定风险评估方法与要点
- 医院手术部新风机组盘管冬季冻裂问题分析及防止方法
- 再谈VRV空调系统设计与施工中有关问题的解决方法
- 有关CAD技术在水利工程设计中的实际应用方法
- 柴油机高压喷油管用钢、高压喷油管及其制造方法
- 用于制冷系统稳定运行时制冷剂分布测试的新方法
- 基于风险接受准则的建筑工程风险评价和决策方法
- 有限元解Biot固结方程时初始参数选取方法
- 智能建筑工程监理过程中的几个问题及处理方法
- 中厚板生产线升级改造设备中心线基准的测量方法
- 再生丁基橡胶-丁基橡胶防水卷材压敏胶的制备及性能
- 指标设置与测度方法
- 基于局部二进制模式的带钢表面缺陷初级检测方法
- 430铁素体不锈钢铸锭等轴晶率的熔炼方法
- 制备质子交换膜燃料电池碳/碳复合材料双极板的方法