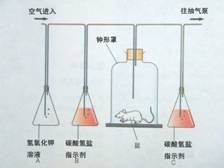
碳酸氢盐指示剂
碳酸氢盐指示剂是一种容易吸收二氧化碳的化学物质,用于检测二氧化碳含量。
碳酸氢盐指示剂基本信息
| 中文名称 | 碳酸氢盐指示剂 | 外文名称 | Hydrogencarbonate indicator |
|---|---|---|---|
| 性质 | 化学物质 | 用于 | 检测二氧化碳含量 |
此溶液由A、B两种溶液组合而成:
A溶液:0.02克百里酚蓝及0.01克甲酚红溶于2毫升的乙醇
B溶液:0.8克碳酸氢钠及7.48克的氯化钾溶于90毫升蒸馏水
将A、B剂混合后以9:1000的比例以蒸馏水稀释即得碳酸氢盐指示剂。
碳酸氢盐指示剂造价信息
碳酸氢盐指示剂常见问题
-
两个都是碱性,你看如果两种碱性物质反应,如氢氧化钠和碳酸氢钠,生成碳酸钠,碳酸钠碱性介于两者之间,而如果题中两物质反应,生成碳酸钙和什么?和碳酸啊,可能么?酸碱反应,只能中和,不能歧化啊(当然比如Cu...
-
碳酸氢铵是一种碳酸盐,化学式为NH4HCO3,相对分子质量79,含氮17。7%左右,是一种无色或浅色化合物,呈粒状,板状或柱状结晶!
-
偏铝酸钠与碳酸氢钠反应的化学方程式为:(沉淀)
碳酸氢盐指示剂文献

 X70管道钢在碳酸盐/碳酸氢盐溶液中的疲劳裂纹扩展试验研究
X70管道钢在碳酸盐/碳酸氢盐溶液中的疲劳裂纹扩展试验研究
完成了一组X70管道钢预制裂纹试件在碳酸盐/碳酸氢盐溶液中阴极保护条件和3种载荷频率(0.1、1.0、5.0 Hz)下的疲劳裂纹扩展试验。结果表明,在较高的载荷频率下,裂纹的扩展以机械作用为主,高pH值的腐蚀环境的影响不明显;如果载荷频率较低,高pH值环境则会促进裂纹的加速扩展。出乎意料的是,其中有2个试件的裂纹在预裂后停止了扩展,而在裂尖表面出现了蚀坑和开裂,这一现象进一步说明循环载荷可以破坏钝化膜的形成,从而导致表面裂纹萌生。

 碳酸钠与碳酸氢钠性质的探究教学设计
碳酸钠与碳酸氢钠性质的探究教学设计
. . 碳酸钠与碳酸氢钠性质的探究 一、教学内容分析 《普通高中化学课程标准》 (实验)指出: “通过以化学实验为主体的多种探究活动,使 学生体验科学研究的过程, 激发学习化学的兴趣, 强化科学探究的意识, 促进学习方式的转 变,培养学生的创新精神和实践能力。 ”因此,在教学中必须强化实验的功能,改变以往的 实验只是起演示和辅助的作用, 培养学生的化学实践能力、 创新精神、 科学方法和合作精神。 本单元内容在呈现方式上有以下特点:实验较多,有利于引起学生的学习兴趣。 Na2CO3、 NaHCO 3 的性质我将采用了科学探究的形式让学生通过自主实验完成这一知识点的学习。 “让学生体验科学探究的过程, 学会科学探究的一般方法”, 并且将科学精神和人文精神自 然的融入教学当中。 充分发挥学生课堂主体地位, 又可充分发掘教师的主导作用, 这样更能 激发学生学习的兴趣和情感。 二、教学流程设计
指示剂选择不当,加之肉眼对变色点辨认困难,都会给测定结果带来误差。因此,在多种指示剂中,选择指示剂的依据是:要选择一种变色范围恰好在滴定曲线的突跃范围之内,或者至少要占滴定曲线突跃范围一部分的指示剂。这样当滴定正好在滴定曲线突跃范围之内结束时,其最大误差不过0.1%,这是容量分析容许的。
双色指示剂的变色范围不受其用量的影响,但因指示剂本身就是酸或碱,指示剂的变色要消耗一定的滴定剂,从而增大测定的误差。对于单色指示剂而言,用量过多,会使用变色范围向pH值减小的方向发生移动,也会增大滴定的误差。例如:用0.1mol/LnaOH滴定0.1mol/LHAc,pHsp=8.5,突跃范围为pH8.70-9.00,滴定体积若为50ml,滴入2-3滴酚酞,大约在pH=9时出现红色;若滴入10-15滴酚酞,则在pH=8时出现红色。显然后者的滴定误差要大得多。
指示剂用量过多,还会影响变色的敏锐性。例如:以甲基橙为指示剂,用HCl滴定NaOH溶液,终点为橙色,若甲基橙用量过多则终点敏锐性就较差。
1、酸碱指示剂。指示溶液中H+浓度的变化,是一种有机弱酸或有机弱碱,其酸性和碱性具有不同的颜色。指示剂酸HIn在溶液中的离解常数Ka=[H+][In-]/[HIn],即溶液的颜色决定于[In-]/[HIn],而[In-]/[HIn]又决定于[H+]。以甲基橙(Ka=10-3.4)为例,溶液的pH<3.1时,呈酸性,具红色;pH>4.4时,呈碱性,具黄色;而在pH3.1~4.4,则出现红黄的混合色橙色,称之为指示剂的变色范围。不同的酸碱指示剂有不同的变色范围。
2、金属指示剂。络合滴定法所用的指示剂,大多是染料,它在一定pH下能与金属离子络合呈现一种与游离指示剂完全不同的颜色而指示终点。
3、氧化还原指示剂。为氧化剂或还原剂,它的氧化形与还原形具有不同的颜色,在滴定中被氧化(或还原)时,即变色,指示出溶液电位的变化。
4、沉淀滴定指示剂。主要是Ag+与卤素离子的滴定,以铬酸钾、铁铵矾或荧光黄作指示剂。
- 相关百科
- 相关知识
- 相关专栏
- 附属式公共厕所
- 流水线标准工作指示图表
- 绅士厕所
- 堆肥式厕所
- 潍坊海达兴
- PE膜收缩包装机
- PE膜防水卷材
- Hammett指示剂法
- PE膜热收缩包装机
- 厕所装置
- PE膜全自动整列收缩包装机
- BS-5540PE膜收缩包装机
- 压力指示剂
- 防烟面具
- 太阳能滴胶板封装胶
- 温度压力指示仪表
- 应用VE进行盐田技术改造
- 利用含钴、镍氢化硅酸盐提高橡胶镀铜钢丝粘合作用
- 氯盐阻锈型防冻剂中引气组分掺量对混凝土性能影响
- GB/T2015-2005白色硅酸盐水泥之白度测定
- 中南大学土木工程材料掺混合材的硅酸盐水泥
- 京新国家高速甘肃段公路工程区盐渍土分布规律与特征浅析
- 江苏省宿淮盐高速公路清浦绕城段绿色通道建设现状与分析
- 深圳盐田区某住宅项目全程广告整合推广企划方案
- 低水胶比下超细粉煤灰不同细度硅酸盐水泥水化历程的影响
- 新疆盐渍土地区南疆线野轮段增建第二线工程地质特征
- 可靠度的氯盐与冻融环境下桥梁耐久性模糊综合评价法
- 投标文件公路工程施工组织设计含盐泽土、附表
- 冻融与氯盐作用下考虑相关随机变量的预应力结构可靠度分析
- 法治建设规范房产市场盐城市房产管理局依法行政纪实
- 核电厂用全焊式不锈钢T型绕丝除盐器滤头功能性试验
- 回归分析法在预测矿渣硅酸盐水泥中的应用