弱电解质定义
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态
例:CH3COOH的电离平衡的建立过程,开始时c(醋酸)最大,而离子浓度最小--为0,所以弱电解质分子电离成离子的速率从大到小变化;离子结合成电解质分子的速率从小到大变化。
弱电解质造价信息
它们的主要区别为:强电解质是可以在水中或熔融状态下完全电离的物质,在电离过程中,强电解质可电离方程式用"="来表示。如 硫酸:
H2SO4=2H + SO4
但是在弱电解质当中要用可逆符号,如果是多元弱酸要分步电离,如下:
例:CH3COOH CH3COO+ H
NH3·H2O NH4 +OH
H2O H + OH
多元弱酸分步电离,多元弱碱一步电离
例: H2CO3 HCO3+ H HCO3 CO3 + H
弱酸:如H₂S、H₂CO₃、CH₃COOH、HF、HCN、HClO等。HF酸是具有强极性共价键的弱电解质。H₃PO₄、H₂SO₃从其酸性强弱看属于中强酸,但仍属于弱电解质。弱电解质必须是化合物,单质不是电解质。
弱碱:一水合氨(氨水) 两性氢氧化物:氢氧化铝,氢氧化锌
个别的盐:如HgCl₂、Pb(Ac)₂、HgBr₂、CdI₂等
水:是由强极性键构成的极弱的电解质。
不同的弱电解质在水中电离的程度是不同的,一般用电离度和电离常数来表示。
电离度的定义和计算:
电离度--弱电解质在溶液里达电离平衡时,已电离的电解质分数占原来总分子数(包括已电离的和未电离的)的百分数。
电离度(α)= (已电离弱电解质分子数/原弱电解质分子数)*100%= (分子、分母同除以阿氏常数)= (分子、分母同除以溶液体积)
弱电解质定义常见问题
-
钡难溶于水,但钡属于强电解质 (钡)BaSO4虽难溶于水,但溶解的部分完全电离,且BaSO4在熔化状态下也能完全电离,故BaSO4是强电解质。 强电解质是指在水溶液或者熔化状态下能完全电离的电解质,...
-
黄色: 溶解酸素、硅化合物、有机矿物质、钼、硅、氟化物、其他有机物绿色: 砷()、汞、铅、铜、钠 蓝色: 细菌、病毒、致癌物质、有机磷等(化肥、洗涤剂和农药)红色: 铁及铁锈、细菌 白色: 铅、锌...
-
CaCO3是强电解质,碳酸钙是碳酸盐类,大部分的盐类都属于强电解质。强电解质:溶于水能够全部电离的电解质,包括强酸、强碱、大多数的盐和活波金属氧化物。弱电解质:溶于水只能部分电离的电解质,包括弱酸、弱...
弱电解质的电离平衡属于化学平衡中的一种,具有以下一些特征:
"逆"--弱电解质的电离是可逆的
"动"--电离平衡是动态平衡
"等"-- v(离子化)=v (分子化)≠0
"定"--在电离平衡状态时,溶液中分子和离子的浓度保持不变。
"变"--电离平衡是相对的、暂时的,当外界条件改变时,平衡就会发生移动
内因:电解质的本身的性质。
外因:温度和溶液的浓度等。
浓度的影响
醋酸稀释时电离度变化的数据:
浓度(mol/L) 0.2 0.1 0.001
电离度(%) 0.948 1.32 12.4
可见,电离度随浓度的降低而增大。(因浓度越稀,离子互相碰撞而结合成分子的机会越少,电离度就越大。)
温度的影响
因为电离过程是吸热的,因此温度升高离子化倾向加强,又因大多数电解质电离时没有显著的热量变化,这就导致温度对电离度虽有影响,但影响并不大的必然结果。一般情况下,温度对电离度影响不大,但水的离解过程显著吸热,所以温度升高可以增大水的电离度。
因此,用电离度比较几种电解质的相对强弱时,就当注意所给条件,即浓度和温度,如不注明温度通常指25℃。
在相同温度和浓度时,电离度的大小可以表示弱电解质的相对强弱。
[例3]下列关于电离度α的叙述正确的是( D )
①α与浓度无关;②α值随温度升高而增大;③在相同条件下,α值的大小可以表示弱电解质的相对强弱;④α值增大,相应离子浓度一定增大;⑤α值增大相应离子物质的量增大。
A.①②③ B.①②④ C.③④⑤ D.②③
电离常数又叫电离平衡常数,用Ki表示。如醋酸,碳酸和硼酸。其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数。一种弱电解质的电离平衡常数只与温度有关,而与该弱电解质的浓度无关。因为弱电解质通常为弱酸或弱碱,所以在化学上,可以用Ka、Kb分别表示弱酸和弱碱的电离平衡常数。
用HA表示弱酸,则其电离方程式为HA--H+A,则电离常数Ka=[H]*[A]/HA
电离常数K与电离度α的关系可近似的表示为K=cα(α平方)其中c为弱电解质溶液的浓度。
弱电解质定义文献

 教学设计--弱电解质的电离平衡资料
教学设计--弱电解质的电离平衡资料
弱电解质的电离平衡 [学情分析 ] 经过前面的学习,学生已经知道弱电解质的电离过程是一个可逆过程,并且最终建立电 离平衡,并且已经熟练掌握化学平衡的理论知识, 已具备运用平衡理论解决实际问题的能力。 预计部分学生将会对浓度、外加物质对电离平衡的影响存在一定的困难,尤其是浓度变化对 弱电解质电离程度大小的影响感到难以理解。 [学习内容分析 ] 该部分知识主要包括 “电离平衡常数 ”、“影响电离平衡的因素 ”两部分内容。该节所学 “电 离平衡常数 ”与前面所学 “化学平衡常数 ”、“水的离子积常数 ”,以及后面将要学习的 “溶度积 常数”都属于平衡常数系列,可让学生对比学习,并为后面的学习埋下伏笔。在前面所学 “外 界条件对化学平衡、水的电离影响 ”的基础上,学习 “影响电离平衡的因素 ”更是水到渠成。学 好本节弱电解质电离平衡的知识,对下节分析溶液中各种离子间的作用,从而探究盐类水解 的

 教学设计弱电解质的电离平衡
教学设计弱电解质的电离平衡
弱电解质的电离平衡 [学情分析 ] 经过前面的学习,学生已经知道弱电解质的电离过程是一个可逆过程,并且最终建立电 离平衡,并且已经熟练掌握化学平衡的理论知识, 已具备运用平衡理论解决实际问题的能力。 预计部分学生将会对浓度、外加物质对电离平衡的影响存在一定的困难,尤其是浓度变化对 弱电解质电离程度大小的影响感到难以理解。 [学习内容分析 ] 该部分知识主要包括 “电离平衡常数 ”、“影响电离平衡的因素 ”两部分内容。该节所学 “电 离平衡常数 ”与前面所学 “化学平衡常数 ”、“水的离子积常数 ”,以及后面将要学习的 “溶度积 常数”都属于平衡常数系列,可让学生对比学习,并为后面的学习埋下伏笔。在前面所学 “外 界条件对化学平衡、水的电离影响 ”的基础上,学习 “影响电离平衡的因素 ”更是水到渠成。学 好本节弱电解质电离平衡的知识,对下节分析溶液中各种离子间的作用,从而探究盐类水解 的

回复0402下载暑期推文:基本概念和理论拓展资料;
回复0369下载等级考一轮复习更新资料。
有一天,笔者收到这样一道题,说是大家答案不统一。
常温下,关于pH相等的盐酸和醋酸溶液(两溶液的OHˉ浓度也相等),下列说法正确的 是( B) A.c(HCl)>c(CH3COOH) B.c(Clˉ)=c(CH3COOˉ) C.等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 D.用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
——2016年4月浙江省普通高中学业水平考试化学试题21题
类似这样的题,上海的老师和学生肯定也不会陌生,再加上下面这道题,感觉就更加完美了。
室温下对浓度、体积均相同的盐酸和醋酸溶液分别采取下列措施,有关叙述不正确的是( C) A. 醋酸溶液的pH值较大 B. 完全中和两溶液,需要浓度相同NaOH溶液的体积相等 C. 两者稀释相同倍数后,pH值变化相等 D. 加足量的锌充分反应后,两溶液中产生的氢气一样多 |
有老师曾经总结过,同浓度和同pH两种情况下强弱电解质在9个方面表现出的不同性质,是不是很~(≧▽≦)/~,可是同学们可千万不要去背(*@ο@*) 哇~,要理解,要理解!!!

图片来源:樊艳平.强弱电解质的比较与判断[J].《数理化学习(高一、二)》,2014(8)
笔者在分析这类问题的时候会牢牢抓住一条:弱电解质是有“潜力(部分电离)”的!
好比下面这张图,同体积起始状态下溶液中H+的浓度(或量)的对比。

我们简单一点,就分析一元的情况。
观上图,同浓度情况下,由于弱电解质是不完全电离的,目前状态H+实力不敌强电解质;而在pH相同情况下(即H+实力相当),同样由于弱电解质是不完全电离的,在初始状态要势均力敌,弱电解质需要比强电解质具备更多的兵力。
在一定条件下,那些潜伏的H+是可以“发光发热”的!好比下面这张图:

H+只要被“激发”是可以满格的!
笔者就是借着弱电解质是有“潜力(部分电离)”的这一条,一路过五关斩六将从题里

了出来啊,

。
可是出题的老师从来都不是按套路出牌啊,比如下面这两道题:
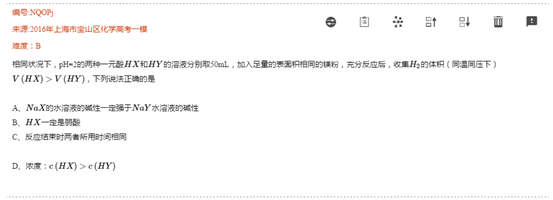
图片来源:通优e帮手平台

两两都是弱电解质这可怎么玩?

可是,还是有一强一弱(*@ο@*) 哇~同样可以用强弱比较模型分析处理。

如果中间来个二元酸呢?


还好,二元酸是强酸!!!注意二元酸中氢离子浓度就可以了。
在公众号内回复【0402】即可下载下列暑期“双基”推文原文和相关拓展资料的PDF版

另外,等级考一轮复习有更新哦,在公众号内回复【0369】即可下载下列试卷的PDF版

订阅用户可获赠本期内容全部word
点击下图可预订等级考一轮复习资料
弱电解质AxBy在水溶液中达到电离平衡时:
则,
式中
电离平衡常数的大小反映弱电解质的电离程度,不同温度时有不同的电离常数。
在同一温度下,同一电解质的电离平衡常数相同,但随着弱电解质浓度的降低,转化率会增大。由该温度下的解离度a=(K/起始浓度)的算术平方根,可得知:弱电解质浓度越低电离程度越大 。
电离平衡方程式
在上述反应过程中,弱电解质分子电离与离子结合成为分子,二者共同构成一组可逆反应。常以弱电解质分子电离出离子的反应方向为正反应方向,以离子重新结合成弱电解质分子的反应方向为逆反应方向。
与化学平衡一样,电离平衡是可以因为条件变化(如浓度、温度、酸碱性等)而移动的,并且也遵循勒夏特列原理。
以下列表归纳了外界条件变化对电离平衡及c(H )的影响,这里假设弱电解质AB可以电离成(A )和(B-),且电离过程吸热,则
| 电离方程式 |
AB=(可逆反应)=(A ) (B-) |
|
| 条件改变内容 |
v(正),v(逆)关系 |
平衡移动方向 |
| 增大c(AB) |
v(正)>v(逆) |
向右 |
| 减小c(AB) |
v(正)<v(逆) |
向左 |
| 增大c(A ) |
v(正)<v(逆) |
向左 |
| 减小c(A ) |
v(正)>v(逆) |
向右 |
| 增大c(B-) |
v(正)<v(逆) |
向左 |
| 减小c(B-) |
v(正)>v(逆) |
向右 |
| 稀释溶液 |
v(正)>v(逆) |
向右 |
| 升高温度 |
v(正)>v(逆) |
向右 |
| 降低温度 |
v(正)<v(逆) |
向左 |
为了便于理解,可以参考醋酸(CH3COOH)的电离平衡,将CH3COOH代入上表的AB,将H 代入A ,将CH3COO-代入B-。
电离平衡电离平衡示例
弱酸:HF↔H F 弱碱:NH3·H2O↔NH4 OH- H2O:H2O↔H OH-
- 相关百科
- 相关知识
- 相关专栏
- QD6000N总线式气体报警控制器
- HGM8130发电机组自动化控制器
- HY5WZ-12.7/45避雷器
- 西门XMG水位控制器
- 可编程控制器技术与应用系统设计
- 压缩机控制器
- HY5WR-10/27避雷器
- 可编程控制器技术应用教程
- 抽水蓄能技术论文集2010
- 现代可编程序控制器网络通信技术
- 可编程控制器综合应用技术
- 可编程序控制器通信与网络
- 电气控制及可编程序控制器
- 可编程序控制器及常用控制电器
- 纳米发电机
- 可编程控制器基础与应用
- 有软弱下卧层时确定天然地基上基础底面积的简便方法
- 招标附件1:九里晴川弱电工程招标清单(0901)
- 医院工程电气、弱电、消防火灾报警安装工程监理细则
- 智能天工-21C智能小区弱电集成系统设计使用手册
- 弱电箱技术标准及要求
- 基于MEMS矢量水听器微弱信号提取电路设计与测试
- 建筑智能化弱电工程施工组织设计方案投标文件技术部分
- 建筑智能化施工中220V强弱电分开问题剖析和处理
- 建模与仿真相关概念、定义和术语
- 基于流固耦合效应软弱围岩隧道CRD法开挖变形分析
- 压力容器焊接常用术语常用焊接工艺比对种类图解定义焊材
- 吉林省建筑设计综合医院的定义与分类试题
- 土钉、土锚联合加固法在带有软弱夹层坑壁加固中的应用
- 弱电配管施工工艺要求
- 弱电系统施工设计方案
- 弱电系统工程部分规程