耐化学性表征方式
耐化学性环境应力龟裂
极性分子对固体的变形与破坏过程也有不利的影响,称为 Rebinder效应。其表现有两个方面。其一是分子链较长的极性物如有机酸和酵,它可以降低材料表面的屈服点,同时使固体的表面能降低,易于在表面出现位错。其二是分子链较短的极性物,它可以渗入表面的微观裂缝中,产住一种楔入力,使裂缝扩展,这种楔入压力在裂缝壁上的尖端处可达10N/mm。 Rebinder效应在形成新的表面,以及在固体尤其是在晶界上存在缺陷的条件下表现得最强。如果表面有残余压缩应力,这种效应就不会出现。
对于聚合物材料,当材料处于某种环境介质中时,往往会比在空气中的断裂应力或曲服应力低得多的负载应力下发生龟裂。这种龟裂就称为环境应力龟裂 (environmental stress cracking)也简称为ESC,而对环境应力的耐受性能称为耐环境应力龟裂(environmental stress cracking resistance),简称ESCR。
环境应力龟裂在聚合物材料中是一种普通现象,其具有以下特点:
①它是一种从表面开始发生破坏的物理现象,从宏观上看呈脆性破坏,但若用电子显微镜观察,则属于韧性破坏。
②不论负载应力是单轴方式或是多轴方式,它总是在比空气中的屈服应力更低的应力下发生龟裂滞后破坏。
③龟裂的尖端部位存在着银纹区(Crazing zone)。
④与应力腐蚀开裂不同,材料并不发生化学变化。
⑤与金属的Rebinder效应不同,在发生龟裂的前期状态中屈服应力不降低。
“环境介质”包括液体、气体及固体,即材料所处的化学环境,所以材料的耐环境应力龟裂性能直接反应了材料的耐化学性的强弱。在实用中材料的环境介质主要是溶液、有机溶剂等,所以一般的耐环境应力龟裂测定法中只考虑“环境液体”。
耐化学性耐环境应力龟裂测定法
聚合物材料的耐环境应力龟裂性能的测定方法因材料种类或使用场景不同而各异,常见材料的耐环境性能测试方法有相应的国家标准,如聚乙烯样品可采用GB/T-1842-2008标准进 行测试,吹模制聚乙烯容器抗环境应力裂纹的测试可采用ASTM D2561-1995标准。
在各类测试方法中,均需将样片制备成标准样品,对其施加恒定的应力或恒定的应变置于特定的液体环境中(如酸、碱、盐溶液、润滑油、胶粘剂、垫圈材料、清洁剂、食品、室内装潢材料等等),并对样品的特定参数(例如银纹数量、最大银纹尺寸、破损时间、屈服强度、屈服时间、断裂时间等)进行分析,通过对比不同样品的特定参数得知其耐化学性的相对强弱。
按照对样品施加的应力恒定或应变恒定可大致将测定方法分为恒定应变法和恒定加载法两类。
-
恒定应变法对待测样品持续施加恒定的应变,并将其浸到试验用环境液中测定其耐环境应力龟裂性能。 弯曲预应变法:将待测样条先在特定的测试夹具上弯曲至特定应变水准(通常0%、0.5%、1.0%以及1.5%应变),接着将预测试的化学药剂施加于样条的最高应变区域上。样条在特定测试时间内一直持续地暴露于应变和化学药剂下研究其耐环境应力龟裂性能。
-
拉伸预应变法:使用能施加恒定拉伸预应变的拉伸机给样条施加恒定的拉伸应变,将预测试的化学药剂施加于样条上研究其耐环境应力龟裂性能。
-
扭转预应变法:将带状样品在金属棒上牢固地卷缠成螺旋状,然后将其浸渍到待测液体浴测定其耐环境应力龟裂性能。
-
恒定加载法对待测样品持续施加恒定的应力,并将其浸到试验用环境液测定其耐环境应力龟裂性能。 单轴加载法:对待测样条施加单轴向的恒定力(拉伸力或挤压力),然后将其浸渍到待测液体浴测定耐环境应力龟裂性能。 多轴加载法:对待测样施加多轴向的恒定力,然后将其浸渍到待测液体浴测定耐环境应力龟裂性能。例如十字形试样法可以对样片施加双轴拉伸应力进行耐环境应力龟裂测试,瓶状样品内部保持恒定压强
耐化学性耐环境应力龟裂测定的应用
聚合物材料的研发和生产中均需要对材料的性能进行测定,通过对材料耐环境应力龟裂性能的测定可以了解材料在制备、加工过程中反应温度、反应时间、引发剂比例、添加剂种类、混炼时间、材料形状等因素对材料耐环境性能的影响,从而可以指导研发生产出更高性能的材料。 2100433B
耐化学性造价信息
聚合物在化学介质的作用下,力学性能和化学性能会发生变化。这是由于在特定介质条件(介质种类、温度、时间及应力)作用下,大分子结构(主价键、分子间力)或材料结构(填料、增强材料、增塑剂)发生变化。
当固体聚合物材料与介质(包括气体、蒸气或液体)接触时,由于大分子热运动,材料内部的自由体积(空隙)发生迁移,使介质分子向内部渗透、扩散。因此,凡是对大分子运动过程及介质分子运动有影响的因素,均对介质的渗透、扩散有影响。首先是聚合物材料结构的影响,其次是介质、温度、压力等的影响。
耐化学性聚合物结构
凡阻碍聚合物大分子链运动的因素(如结晶,交联)都会使聚合物渗透系数减小,结晶性聚合物的渗透系数随结晶度的增大而降低。聚合物渗透系数越小其耐溶剂性越好。
耐化学性化学介质
化学介质的极性对介质在聚合物中的渗透、扩散影响很大。两者极性相似时,化学介质对聚合物有增塑作用,削弱了大分子间的作用力,有利于大分子链段的运动,加速了化学介质在材料中的扩散。反之,化学介质与聚合物的极性相差较大时,则对介质的渗透和扩散很不利。例如,聚乙烯为非极性聚合物,一般极性的酸、碱和盐的水溶液及有机溶剂醇类在聚乙烯中渗透量就很小;而极性小的芳烃、汽油、卤代烃的渗透性相对就较大。极性高分子如聚乙烯醇、聚醚和大多数纤维素衍生物,则能受极性介质(如水和醇等)溶胀和溶解,但耐非极性有机溶剂。
耐化学性环境温度
对于聚合物材料,环境温度高,大分子链活动能力强,透气率k增大。k与温度的关系符合阿伦尼乌斯方程:
k= Aе-E /(RT)
式中 k——透气率
A——常数
E——渗透活化能,其单位为J·mol-1
R——摩尔气体常数,约为8.314J/mol·K
T——热力学温度,单位K
渗透活化能E随介质和极性的增大而增大,随聚合物的内聚能密度增大而增大。当温度升高时,聚合物对气体和水蒸气的透过率增大。由此可见温度越高,聚合物材料耐化学性越差。
耐化学性相对湿度
由环境相对湿度的变化而引起聚合物透气率的改变只发生在含有羟基或酰胺基的聚合物中,表现为随着相对湿度的增加,聚合物的透气率增加,如乙烯-乙烯醇共聚物(EVOH)、聚乙烯醇(PVA)、聚酰胺(PA)都为阻气性材料。当环境的相对湿度提高后,含有亲水基团的材料含水率增加,使它们的阻气性急剧下降。出现这种现象的原因是水分子与包装材料中的羟基或酰胺基形成氢键,造成主链松弛,使阻气性下降。
耐化学性表征方式常见问题
-
对于苯环上的两个取代,邻,间,对三种,对位取代是最稳定的!所以对笨二甲酸的耐化学性好,比较稳定,不容易发生反应。
-
对于路基及路面基层,压实度是指工地实际达到的干密度与室内标准击实实验所得的最大干密度的比值;对沥青路面压实度是指现场实际达到的密度与室内标准密度的比值。
-
环氧树脂的耐热性一般用热变形温度来表征,环氧树脂是由环氧树脂为基的双组分耐高温胶粘剂,主要适用于耐高温金属、陶瓷等的胶接。其使用温度工作温度为-50~+180℃,短时可达+250℃。环氧树脂主要用于金...
耐化学性表征方式文献

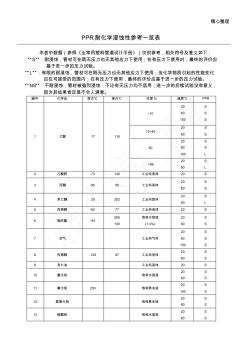 PPR耐化学性能表
PPR耐化学性能表
精心整理 PPR耐化学浸蚀性参考一览表 本表中数据(参照《业常用塑料管道设计手册》)仅供参考,相关符号及意义如下: “S”:耐浸蚀,管材可在既无压力也无其他应力下使用;在有压力下使用时,最终的评价应 基于进一步的压力试验。 “L”:有限的耐浸蚀,管材可在既无压力也无其他应力下使用;但化学物质引起的性能变化 应在可接受的范围内;在有压力下使用,最终的评价应基于进一步的压力试验。 “NS”:不耐浸蚀,管材被强烈浸蚀:不论有无压力均不适用;进一步的后续试验没有意义, 因为其结果肯定是不令人满意。 编号 化学品 熔点℃ 沸点℃ 浓度% 温度℃ PPR 1 乙酸 17 118 ~10 20 60 100 S S S 10~40 20 60 S S 50 20 60 100 S S L >96 20 60 S L 2 乙酸酐 -73 140 工业纯液

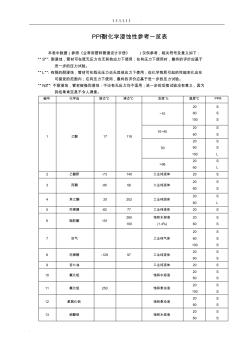 PPR耐化学性能表 (2)
PPR耐化学性能表 (2)
1.1.1.1.1.1 . . PPR耐化学浸蚀性参考一览表 本表中数据(参照《业常用塑料管道设计手册》 )仅供参考,相关符号及意义如下: “S”:耐浸蚀,管材可在既无压力也无其他应力下使用;在有压力下使用时,最终的评价应基于 进一步的压力试验。 “ L”:有限的耐浸蚀,管材可在既无压力也无其他应力下使用;但化学物质引起的性能变化应在 可接受的范围内;在有压力下使用,最终的评价应基于进一步的压力试验。 “NS”:不耐浸蚀,管材被强烈浸蚀:不论有无压力均不适用;进一步的后续试验没有意义,因为 其结果肯定是不令人满意。 编号 化学品 熔点℃ 沸点℃ 浓度% 温度℃ PPR 1 乙酸 17 118 ~10 20 60 100 S S S 10~40 20 60 S S 50 20 60 100 S S L >96 20 60 S L 2 乙
尼龙管最适应于:压缩空气系统,润滑系统,可燃性油类流体管路,液压管路,部分化学性流体,食品类流体 该品质量轻,耐潮湿,耐盐水海水,抗老化性好,耐日晒光曝,十通尼龙管一般用于烃类,芳香族,脂肪族溶剂,油料,燃料及致冷剂,不耐强酸,强碱,酚类等;常用输送流体:40度碳酸苏打,40度碳酸水,-20~40度醇,蒸馏水,海水,油类等 。
锝的电化学性质介于铼和锰之间,更接近于铼。锝的重要化合物有两种氧化锝、卤化锝、两种硫化锝等。
锝在空气中加热到500℃时,燃烧生成溶于水的Tc2O7:
锝在氟气中燃烧生成TcF5和TcF6的混合物,和氯气反应生成TcCl4和其他含氯化合物的混合物。锝和硫反应生成TcS2。锝不和氮气反应。锝不溶于氢卤酸或氨性H2O2中,但溶于中性或酸性的H2O2溶液中。
铁单质与铁离子性质
铁的电子排布式:(Ar)核外电子3d6 4s2
Fe相对原子质量55.847,计算用56。铁有多种同素异形体,如α铁、β铁、γ铁、б铁等。
铁是比较活泼的金属,在金属活动性顺序表(K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au)里排在氢的前面。
铁的化学性质活泼,三价铁为强氧化剂
铁的最重要的氧化态是+2和+3。
二价铁离子呈淡绿色,在碱性溶液中易被氧化成三价铁离子。三价铁离子的颜色随水解程度的增大而由黄色经橙色变到棕色。纯净的三价铁离子为淡紫色。
二价和三价铁均易与无机或有机配位体形成稳定的配位化合物,如 Phen为菲罗林,配位数通常为6。零价铁还可与一氧化碳形成各种羰基铁,如Fe(CO)5、Fe2(CO)9、Fe3(CO)12。羰基铁有挥发性,蒸气剧毒。
铁也有+4价态的化合物,但在水溶液中只有+3价的。
含碳量较大的铁叫做生铁,C含量一般大于2%
钢铁是有无数原电池构成的,C含量较小,约2%
原电池反应
【析氢腐蚀】
(-) Fe — 2e- === Fe2+
(+) 2H+ + 2e- === H2(气体符号)
【吸氧腐蚀】
(-)Fe — 2e- === Fe2+
(+)O2+H2O+4e- === 4OH-
酸性条件析氢腐蚀、中性碱性条件下吸氧腐蚀
化合物
主要有两大类:亚铁Fe(Ⅱ)和正铁Fe(Ⅲ)化合物。
亚铁化合物有氧化亚铁(FeO)、氯化亚铁(FeCl2)、硫酸亚铁(FeSO4)、氢氧化亚铁{Fe(OH)2}等;正铁化合物有三氧化二铁(Fe2O3)、三氯化铁(FeCl3)、硫酸铁{Fe2(SO4)3}、氢氧化铁{Fe(OH)3}等。
如在六氰根合铁(Ⅱ)酸钾K4[Fe(CN)6](俗名:黄血盐)和六氰根合铁(Ⅲ)酸钾K3[Fe(CN)6](俗名:赤血盐)中。铁与环戊二烯的化合物二茂铁,是一种具有夹心结构的金属有机配合物。
氧化性:
Cl2 > Br2 > Fe3+ > I2 > S
还原性:
S2- > I- > Fe2+ >Br- > Cl-
①铁的价态及其氧化物
氧化态有0、+2、+3、+4。
氧化物: 氧化亚铁、氧化铁、四氧化三铁(含两种价态,两个三价,一个二价)
②与非金属反应(Cl、O2、S等):
常温时,铁在干燥的空气里不易与氧、硫、氯等非金属单质起反应,在高温时,则剧烈反应。
在室温条件下可缓慢地从水中置换出氢,在500℃以上反应速率增高:
3Fe+4H2O(g)=== Fe3O4+4H2(气体符号一般不标)
铁在氧气中燃烧,生成四氧化三铁,炽热的铁和水蒸气起反应也生成Fe3O4。铁易溶于非氧化性酸如盐酸和稀硫酸中,生成二价铁盐,并放出氢气,常温遇浓硫酸浓硝酸钝化,稀硝酸发生氧化还原反应,故可用铁制品盛装浓硫酸或浓硝酸(铁器不可受热)。
3Fe+2O2=点=燃=Fe3O4
2Fe+3Cl2=点=燃=2FeCl3
Fe+S===FeS(加热)
③与硝酸
铁与(过量)浓硝酸:1mol铁与6mol浓硝酸 加热反应生成 1mol硝酸铁、3mol二氧化氮和3mol水
(过量)铁与浓硝酸:1mol铁与4mol浓硝酸 加热反应生成 1mol硝酸亚铁、2mol二氧化氮和2mol水
铁与(过量)稀硝酸:1mol铁与4mol硝酸 反应生成 1mol硝酸铁、1mol一氧化氮和2mol水
(过量)铁与稀硝酸:3mol铁与8mol硝酸 反应生成 3mol硝酸亚铁、2mol一氧化氮和4mol水
铁与冷浓硝酸: 钝化
④工业制取
(还原铁矿) Fe2O3+C(高温条件下)===2Fe+3CO
Fe2O3+3CO(高温条件下)===2Fe+3CO2
⑤编写及排版人为高中生铁元素单元考试复习用,未补完全,请老师们补充更专业的知识
- 相关百科
- 相关知识
- 相关专栏
- 耐压式称重给煤机
- 耐压强度
- 耐大气腐蚀用钢
- 耐寒植物
- 耐微生物腐蚀性
- 耐林新型建筑材料(常州)有限公司
- 耐正负高压的SCRESD防护器件及其工艺方法
- 耐氏家别墅庭院景观设计公司
- 耐氧化处理
- 耐水喷雾
- 耐油耐溶剂性
- 耐溶剂性
- 耐溶剂特性
- 耐火保温材料市场分析预测与产业投资建议分析报告
- 耐火制品分型规则
- 耐火制品
- 多方式远程控制门禁系统
- 政府采购非招标采购方式管理办法(财政部第74号)
- 永城火电厂300MW机组给水泵驱动方式的优化选择
- 应急柴油发电机组安装00D272机组冷却方式
- 智能门锁操作方式Zigbee模块安装
- 政府采购非招标采购方式管理办法(财政部74号令)
- 政府采购非招标采购方式管理办法(财政部令74号)
- 关于严禁政府投资项目使用带资承包方式进行建设通知
- 工业固体废物处置中心30td焚烧耐火材料施工方案
- 关于地下室室内消火栓系统展开图表达方式总结与探新
- 关于广东省韩江高陂水利枢纽工程移民生产安置方式
- 基于Airpak空调送风方式对室内热环境影响分析
- 机械设计图纸标注知识工程制图标注标注方法、方式要点
- 关于建筑业简易计税方式下分包抵税相关问题一点思考
- 基于BIM技术房屋建筑学课程设计考核方式改革
- 广东省一级建筑师建筑物理与设备照明方式考试题