可滴定酸
可滴定酸度是植物品质的重要构成性状之一,是影响果实风味品质的重要因素。
可滴定酸基本信息
| 中文名称 | 可滴定酸 | 意 义 | 植物品质的重要构成性状 |
|---|---|---|---|
| 植物种类 | 果树作物 | 作 用 | 是影响果实风味品质 |
1.试材 新鲜或冷冻的植物材料
2.仪器 高速组织捣碎机(10000-12000r/min)、电子天平(感量0.01)、电热恒温水浴锅;50mL移液管、100、60mL烧杯、250mL容量瓶、7cm漏斗、250mL锥形瓶、50mL碱式滴定管等玻璃仪器及12.5cm快速滤纸等。
3.试剂 0.1mol/L氢氧化钠标准溶液、酚酞指示剂及10g/L的95% 乙醇溶液等。
可滴定酸造价信息

可滴定酸方法步骤
1.样品提取液制备 剔除试样的非可食部分(冷冻制品预先在加盖的容器中解冻),用四分法分取可食部分切碎混匀,称取250g,准确至0.1g,放入高速组织捣碎机内,加入等量水,捣碎1~2min。每2g匀浆折算为1g试
样,称取匀浆50~100g,准确至0.1g,用100mL水洗入250mL容量瓶,置75~80℃水浴上加热30min,期间摇动数次,取出冷却,加水至刻度,摇匀过滤。
2.测定 根据预测酸度,用移液管吸取50或100mL样液,加入酚酞指示剂5~10滴,用氢氧化钠标准溶液滴定,至出现微红色30S内不退色为终点,记下所消耗的体积。
结果计算
(1)试样的可滴定酸度以每100g或100mL中氢离子毫摩尔数表示,按下式计算:
可滴定酸度[mmol/100g(mL)]=[(c×V1)/V0]×[250/m(V)]×100
式中:c——氢氧化钠标准溶液摩尔浓度
V1——滴定时所消耗的氢氧化钠标准溶液体积(mL)
V0——吸取滴定用的样液体积(mL)
m(V)——试样质量(g)或体积(mL)
250——试样浸提后定容体积(mL)
(2)试样的可滴定酸度以某种酸的百分含量表示,按下式计算:
可滴定酸度(%)=[(c×V1×k)/V0]×[250/m(V)]×100
式中:k——换算为某种酸克数的系数,见表4-4。其余符号同上式
表4-4 几种酸的换算系数(k)

可滴定酸介绍
对于鲜食品种,一般来讲,高糖中酸,风味浓,品质优;对于加工品种,则要求高糖高酸。因此,可滴定酸的定量研究对果树的品质育种具有重要意义。
可滴定酸常见问题
-
时间长短对EDTA的消耗量影响不大
-
镍离子浓度分析一. 分析方法1.用1ml的移液管取1ml样品于250ml干净之锥形瓶中。2.加纯水或去离子水稀释至100ml。3.加入10ml 50%的氨水溶液。4.加入过量的MX指示剂,至橙黄色。...
-
全自动滴定管使用方法: 1、在装滴定液前,须将滴定管洗净,使水自然沥干(内壁应不挂水珠),先用少量标准溶液荡洗三次,(每次约5~10ml),除去残留在管壁和下端管尖内的水,以防装入标准溶液被水稀释。...

可滴定酸原理
本实验的主要原理:试样浸出液以酚酞为指示剂,用0.1mol/L氢氧化钠标准溶液滴定。本试验用水应是不含二氧化碳的或中性蒸馏水,可在使用前将蒸馏水煮沸、放冷,或加入酚酞指示剂用0.1mol/L氢氧化钠溶液中和至出现微红色。有些果蔬样液滴定至接近终点时出现黄褐色,这时可加入样液体积的1~2倍热水稀释,加入酚酞指示剂0.5~1mL,再继续滴定,使酚酞变色易于观察。通过实验,学习并掌握用指示剂滴定法测定样品可滴定酸的原理和方法。
可滴定酸文献

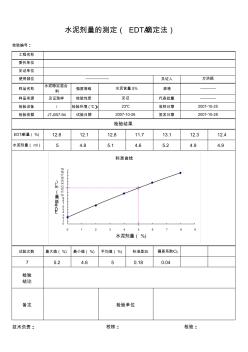 水泥EDTA滴定
水泥EDTA滴定
工程名称 委托单位 见证单位 使用部位 见证人 样品名称 水泥稳定混合 料 强度等级 规格 样品来源 见证取样 检验性质 代表批量 检验设备 / 检验环境 (℃) 收样日期 检验依据 JTJ057-94 试验日期 签发日期 EDTA耗量(%) 12.6 12.1 12.8 11.7 13.1 12.3 12.4 水泥剂量( ml) 5 4.8 5.1 4.6 5.2 4.9 4.9 试验次数 最大值(%) 最小值(%) 平均值(%) 标准差S 偏差系数CV 7 5.2 4.6 5 0.18 0.04 技术负责: —————— 万洪顺 水泥含量 5% ———— 水泥剂量的测定( EDTA滴定法) 检验编号: 见证 23℃ 2007-10-26 检验结果 ———— 2007-10-28 2007-10-25 检验 结论 校核: 检验: 备注 检验单位 0 1 2 3 4

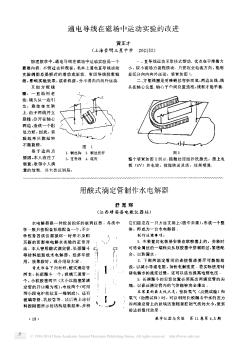 用酸式滴定管制作水电解器
用酸式滴定管制作水电解器
用酸式滴定管制作水电解器舒宽辉(江西靖安县电教仪器站)水电解器是一种较易损坏的玻璃仪器.各类中学一般只按配备标准配备一个,不少学校常因该仪器损坏一时来不及购买新的而影响电解水实验的正常开出.本人曾用酸式滴定管、长颈漏斗等材料组装成水电解器,经多年使用...
当滴入NaOH液20.02ml(化学计量点后0.1%)时,则pOH=4.30 pH=9.70
根据滴定过程中各点的pH值,得滴定曲线图4-2。
从图4-2可以看出:
(1)滴定突跃范围较小,pH值范在7.75~9.70之间。
(2)计量点的pH值不是7而是8.72,计量点落在碱性范围内。这是因为滴定产物醋酸钠为强碱弱酸盐。水解后显碱性。
(3)本滴定宜选择在碱性范围内变色的指示剂,如酚酞或百里酚酞等。
(4)影响突跃范围的因素
①Ka:当浓度一定时,Ka愈大,突跃范围愈大。当Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点。 ②浓度:当Ka一定时,酸的浓度愈大,突跃范围也愈大。根据滴定误差应<0.1%的要求,一般来说,当C·Ka>10-8时,才能以强碱直接滴定弱酸。
强碱滴定弱酸的缺点:
人与人之间误差较大,滴定终点不好掌握。
NH4SCN=76.127.612g→1000ml
【配制】取硫氰酸铵8.0g,加水使溶解成1000ml,摇匀。
【标定】精密量取硝酸银滴定液(0.1mol/L)25ml,加水50ml,硝酸2ml与硫酸铁铵指示液2ml,用本液滴定至溶液微显淡棕红色,经剧烈振摇后仍不褪色,即为终点。根据本液的消耗量算出本液的浓度,即得。
硫氰酸钠滴定液(0.1mol/L)或硫氰酸钾滴定液(0.1mol/L)均可作为本液的代用品。
C2H2O4·2H2O=126.076.304g→1000ml
【配制】取草酸6.4g,加水适量使溶解成1000ml,摇匀。
【标定】精密量取本液25ml,加水200ml与硫酸10ml,用高锰酸钾滴定液(0.02mol/L)滴定,至近终点时,加热至65℃,继续滴定至溶液显微红色,并保持30秒钟不褪;当滴定终了时,溶液温度应不低于55℃。根据高锰酸钾滴定液(0.02mol/L)的消耗量,算出本液的浓度,即得。
如需用草酸滴定液(0.25mol/L)时,可取草酸约32g,照上法配制与标定,但改用高锰酸钾滴定液(0.1mol/L)滴定。
【贮藏】置玻璃塞的棕色玻璃瓶中,密闭保存。
- 相关百科
- 相关知识
- 相关专栏
- Pro/ENGINEER Wildfire实用设计百例
- Ariete MOD4170
- 世界十大危险建筑
- 抗氧化功能评价方法
- 不皂化物含量
- 白术内酯
- 化工总控工
- 旋转式蒸发仪
- 纺织品甲醛测试仪
- 三泉中石
- RE-52B型旋转蒸发仪
- 旋转蒸发仪R-210/215
- 水泥及其原燃料化验方法与设备
- 化学实验技术1
- 工业微生物实验技术
- 第二代气相分子吸收光谱仪
- 可替代现有隔热保温材料的新型材料
- 影响萘高效减水剂与普通硅酸盐水泥适应性的关键因素
- cnas-cc012007新版认可规范
- 以变性剂石灰石—磷渣混合物为基料的白色硅酸盐水泥
- 在8度地震区建造低层纯钢框架结构住宅的可行性分析
- 主要用固体工业废渣生产硫铝酸盐水泥熟料的方法
- 影响常温固化FEVE氟碳涂料耐酸碱性能的因素
- 以可靠性为中心的修在医疗设备维修领域的应用综述
- 可关断晶闸管(GTO)直接门极驱动电路
- 在长距离隧道施工中可更换螺旋机耐磨块的实用性
- 榆横煤化工业园区水资源的保护利压与可持续发展分析
- 榆横煤化工业园区水资源的保护利用与可持续发展分析
- 张河湾公司计算机监控系统国产化改造可行性
- 中海油惠州石化丙稀酸及酯工程项目部JHA分析表
- 在房地产开发中如何运用法律防范可能发生的违约行为
- 云南重点项目-石材产业园区建设项目可行性报告