极限摩尔电导率
科尔劳许(Kohlrausch)根据大量的实验数据,发现浓度小于0.001mol/L的强电解质溶液中,摩尔电导率与浓度c的二次方根存在线性关系。
极限摩尔电导率基本信息
| 中文名称 | 极限摩尔电导率 | 外文名称 | limiting molar conductivity |
|---|---|---|---|
| 发现者 | Kohlrausch科尔劳许 | ||
实际上,由于溶液的离子的相互作用,只有溶液无限稀释,摩尔电导率才能真正反映出该强电解质的导电能力,称为极限摩尔电导率Λm∞。
对于弱电解质,稀释使得解离度迅速增大,溶液中离子数目急剧增加,因此摩尔电导率迅速上升。而且浓度越低,上升越显著。不存在上述线性关系。
极限摩尔电导率造价信息
极限摩尔电导率常见问题
-
电导率 (electric conductivity) 是表示物质传输电流能力强弱的一种测量值。当施加电压于导体的两端时,其电荷载子会呈现朝某方向流动的行为,因而产生电流。电导率 是以欧姆定律定义为电...
-
配制0.01mol/L的氯化钾溶液,将电导率仪调至校正档,把电极浸入氯化钾溶液中,在25℃时的电导率为1408.8μS/cm,如读数显示不正确,调节校正旋钮至读数显示1408.8。
-
1%,纯用强酸碱,这浓度太高了吧,聚酰胺RO膜也就能耐2~11的PH,聚砜膜更差了,通常情况下用2%柠檬酸加少量盐酸调至PH3~4左右酸洗,用0.8%EDTA-2NA加2%STPP用NaOH调到PH1...
极限摩尔电导率文献

 多电极海水电导率测量电路
多电极海水电导率测量电路
本文讨论了七种多电极电导率测量电路及多电极结构。分析了各种电路的测量原理,不同电极数目的电导池各个电极所完成的功能。

 电渗析器出水电导率的预测
电渗析器出水电导率的预测
对DSX-03型电渗析器出水电导率δ(μg/cm)与时间t(min)之间的关系进行了考查,结果显示在一定时间内两者星线性关系,其回归方程预测值与实测值相吻合。

摩尔电导率关系
当浓度降低时,粒子之间相互作用减弱,正、负离子迁移速率加快,溶液的摩尔电导率必定升高。但不同的电解质,摩尔电导率随浓度降低而升高的程度也大不相同。当浓度降低到一定程度后,强电解质的摩尔电导率接近为一定值,而弱电解质的值仍在继续变化。
若在同一浓度区间内比较各种摩尔电导率值的变化,例如就NaCl,H2SO4,CuSO4互相比较,就会发现,当浓度降低时,各个摩尔电导率值的变化程度不同。CuSO4变化最大,H2SO4次之,而NaCl变化最小。这是因为2-2价型盐类离子之间的吸引力较大,当浓度改变时,对静电引力的影响较大,所以摩尔电导率值的变化也较大。 强电解质通常当浓度在0.001mol·dm-3以下时,Λm与√c之间呈线性关系Λm与浓度c之间有如下关系:
其中β在一定温度下,对于一定的电解质和溶剂而言是一个常数。Λm(∞)为溶液在无限稀释时的摩尔电导率,又称为极限摩尔电导率。
极限电导率limiting condu}ti}iry无限稀释路液的电导率,如极限当量电导率、离子的极限摩尔电导率等
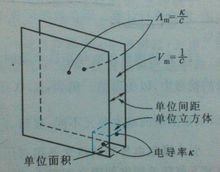
摩尔电导率计算公式
由于对不同的电解质均取1mol,但所取溶液的体积Vm将随浓度而改变。设c是电解质溶液的浓度(单位为mol·m-3),则含1mol电解质的溶液的体积Vm应等于1/c,根据电导率κ的定义,摩 尔电导率Λm与电导率k之间的关系用公式表示为
Λm=k·Vm=k/c
其中k的单位为S·m-1 ,c的单位为mol·m-3,所以摩尔电导率Λm的单位为S·m2·mol-1
- 相关百科
- 相关知识
- 相关专栏
- DDS-307A雷磁电导率仪
- 补偿电导率
- DDS-11A数字电导率仪
- 风扇灯
- 笔式电导率
- GLI3400系列高性能电导率探头
- 电导率测定
- 电导率测试仪器
- 电导率笔
- 手持式电导率测定仪
- 实验室电导率仪
- 土壤电导率
- 摩尔电导率
- 超纯水电导率测试仪
- 涡流电导率仪
- DDS-11A数显电导率仪
- 应用复合梁单元实现钢管混凝土拱桥的极限承载力分析
- 圆柱支撑中空超高摩尔质量聚乙烯烧结过滤板性能对比
- 有埋深无体积质量的黏性土地基极限承载力的直接求解
- 厚壁冷弯方矩管和热轧H型钢轴压极限承载力对比
- 基于ANSYS圆钢管混凝土轴压短柱极限承载力分析
- 基于混沌优化神经网络单桩竖向极限承载力预测方法
- 基于土质边坡塑性极限分析条分法可靠度计算方法
- 基于最小二乘支持向量机回归单桩竖向极限承载力预测
- 电导率成像系统在水电隧洞工程地质灾害预报中的应用
- 卷边槽钢偏心受压构件极限承载力的直接强度计算方法研究
- 工程软土地基中桩基础单桩竖向极限承载力影响因素
- 钢筋混凝土深受弯构件承载能力极限状态计算
- 新编普通钢筋混凝土电杆配筋极限抵抗弯矩曲线应用举例
- 先张法预应力混凝土管桩抗裂弯矩和极限弯矩计算式
- 贡献度极限学习机理论算法的输电线路工程造价预测
- ANFIS的单桩极限承载力预测及可靠度分析与设计
