金属和金属材料
金属和金属材料基本信息
| 中文名 | 金属和金属材料 | 提供学校 | 襄樊二十中 |
|---|---|---|---|
| 主讲教师 | 王奥妮 | 类 别 | 微课 |
从中考角度梳理出本单元考点,并将每个考点涉及到的知识点一一罗列,逐个突破。
金属和金属材料造价信息
系统复习《金属和金属材料》,从三大板块、六个考点进行知识点的讲解,让学生构建知识网络,掌握高频考点。
金属和金属材料常见问题
-
有黑色金属与有色金属。
-
下面是几类比较常用的金属材料:1.钢铁材料 可以分为工程结构钢,机器零件用钢,工模具钢,不锈钢,耐热钢,铸铁几类,具体下面的分类还有很多。2.有色金属合金: 铝合金(变形铝合金和铸造铝合金),铜合金(...
-
金属材料是最重要的工程材料,包括金属和以金属为基的合金。工业上把金属和其合金分为两大部分: ( 1 )黑色金属材料 —— 铁和以铁为基的合金(钢、铸铁和铁合金)。 ( 2 )有色...
金属和金属材料文献

 金属和金属材料(word)
金属和金属材料(word)
金属和金属材料( word) 一、金属和金属材料选择题 1.甲、乙、丙、丁四种金属。甲即使在高温时也不与氧气反应。乙、丙、丁在一定条件下 都能与氧气反应。丁盐的水溶液可用丙制的容器盛放,但不能用乙制的容器盛放。这四种 金属的活动性由强到弱的顺序是 A.甲 >乙>丁>丙 B.丙 >丁>乙 >甲 C.丙 >乙>丁 >甲 D.乙 >丁>丙>甲 【答案】 D 【解析】 【分析】 【详解】 由甲即使在高温下也不与氧气反应知,甲最不活泼,由丁盐能与乙反应但不与丙反应知, 乙的活动性最强,丙的活动性比丁弱,综上所述,四种金属的活动性由强到弱的顺序为: 乙>丁>丙>甲;故选 D。 2.关于银的性质描述中,属于化学性质的是 ( ) A.银是银白色的 B.银不易与氧气反应 C.银具有优良的导电性 D.银具有良好的延展性 【答案】 B 【解析】 必须经化学变化才能表现的性质叫化学性质,不需要发生化学变化就能表现

 金属和金属材料知识点
金属和金属材料知识点
. Word 文档 九年级化学 第八单元 金属和金属材料(知识点) 第一课时 金属材料 一.金属 1.金属材料 金属材料包括纯金属和它们的合金。 ①人类从石器时代进入青铜器时代,继而进入铁器时代, 100 多年前才开始 使用铝。 ②铁、铝、铜和它们的合金是人类使用最多的金属材料,世界上年产量最多 的金属是铁,其次是铝(铝的密度小,抗腐蚀性强,在当今社会被广泛使用) 2.金属的物理性质 金属具有很多共同的物理性质:常温下金属都是固体(汞除外) ,有金属光泽, 大多数金属是电和热的优良导体,有延展性,能够弯曲,密度大,熔点高。 ① 金属除具有一些共同的物理性质外,还具有各自的特性,不同种金属的颜 色、硬度、熔点、导电性、导热性等物理性质差别较大。 ② 铁、铝、银、铂、镁等金属呈银白色,铜却呈紫红色,金呈黄色。 ③ 常温下,铁、铝、铜等大多数金属是固体,但体温计中的汞(俗称水银) 却是液体。
模块一 金属材料
一、金属材料:
金属材料包括纯金属以及它们的合金。
二、金属的物理性质
1、在常温下一般为固态(汞为液态),有金属光泽(大多数金属呈银白色,铜呈紫红色,金呈黄色);
2、导电性、导热性、熔点较高、延展性、能弯曲、硬度较大、密度较大。
三、金属之最
1、地壳中含量最多的金属元素——铝
2、人体中含量最多的金属元素——钙
3、目前世界年产量最多的金属——铁(铁>铝>铜)
4、导电、导热性最好的金属——银(银>铜>金>铝)
5、熔点最高的金属——钨
6、熔点最低的金属——汞
7、硬度最大的金属——铬
8、密度最大的金属——锇
9、密度最小的金属——锂
四、金属的分类

五、金属的应用
物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素。在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
1、铜、铝——电线——导电性好、价格低廉
2、钨——灯丝——熔点高
3、铬——电镀——耐腐蚀性
4、铁——菜刀、镰刀、锤子等
5、汞——体温计液柱
6、银——保温瓶内胆
7、铝——“银粉”、锡箔纸
六、合金
1、合金:由两种或两种以上的金属或金属与非金属经一定方法所合成的具有金属特性的物质。合金是混合物。目前已制得的纯金属只有90多种,而合金已达几千种。
2、合金的硬度一般比组成它的纯金属的硬度大,抗腐蚀性强。
3、合金的熔点一般比组成它的纯金属的熔点低。
4、常见的合金:
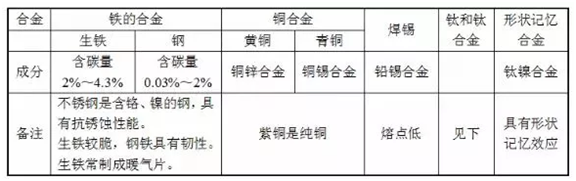
5、钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体具有良好的“相容性”,可用来造人造骨。钛和钛合金的优点:
①熔点高、密度小;
②可塑性好、易于加工、机械性能好;
③抗腐蚀性能好。
6、生铁和钢性能不同的原因:含碳量不同。
模块二 金属的化学性质
一、金属与氧气的反应
1、镁、铝:
(1)在常温下能与空气中的氧气反应:
2Mg+O2=2MgO ;4Al+3O2=2Al2O3
(2)铝的抗腐蚀性能好的原因:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
2、铁、铜
(1)在常温下、干燥的环境中,几乎不与氧气反应,但在潮湿的空气中会生锈。
(2)铁、铜在高温时能与氧气反应:
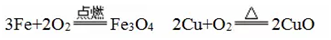
3、金即使在高温时也不与氧气反应。
二、金属与酸的反应:
活泼金属+酸 → 盐+氢气
描述现象时,需要注意:
① 如果有铁、铜元素参加反应,一定要注意溶液颜色的变化;
② 反应放热,但是只有镁和酸反应时放热现象明显。
三、置换反应:
由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应是置换反应。
当铁单质参加置换反应时,生成物中的铁元素呈+2价。
四、常见金属在溶液中的活动性顺序:

1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸(不可以用浓硫酸和硝酸)中的氢。
3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。(钾、钙、钠不符合这一条。它们会先和水反应生成碱和氢气,然后碱和盐反应。)
五、金属与盐溶液的反应:
金属+盐→另一金属+另一盐
(条件:“前换后,盐可溶”)
在活动性顺序中,金属的距离大的,反应先发生。一个置换反应结束后,另一个置换反应才会发生。如在硫酸亚铁和硫酸铜的混合溶液中加入锌粒,锌会先和硫酸铜反应,反应完毕后锌才和硫酸亚铁反应。
六、“湿法冶金”的反应原理:
Fe+CuSO4=Cu+FeSO4
七、颜色
Fe2+的盐溶液是浅绿色的,Fe3+的盐溶液是黄色的,Cu2+的盐溶液是蓝色的。
八、比较Cu、Fe、Ag三种金属的活动性顺序
1、使用铁、银和溶液,一次性得出结果:
操作及现象:把铁、银分别放入硫酸铜溶液中,银表面没有现象;而铁表面会附着一层红色物质,并且溶液会由蓝色逐渐变为无色。
2、使用铜、硫酸亚铁溶液和硝酸银溶液,一次性得出结果:
操作及现象:把铜分别放入硫酸亚铁溶液和硝酸银溶液中,硫酸亚铁溶液没有现象;而在硝酸银溶液中,铜表面会附着一层白色物质,溶液由无色逐渐变为蓝色。
3、选用试剂时,要根据金属活动性顺序表将三种金属排序,然后将排在中间的金属变成盐溶液,或者将排在两边的金属变成盐溶液,这样才能一次性得出结果。
德智教育专注于初高中在线教育,关注德智便利贴,了解更多教育以及初高中各科学习方法与技巧、中考以及高考相关资讯,请关注微信【德智便利贴】,微信公众号:dezhitips
用于非金属和金属材料的黏合。
初中 化学
1.四.身边的化学物质/8.金属和金属材料/H.金属活动性反应顺序问题
- 相关百科
- 相关知识
- 相关专栏
- 金属和金属氧化物纳米晶体的表面结构控制及功能调控
- 金属喷墨彩印机
- 金属型覆砂铸造
- 金属基纳米复合材料脉冲电学轩技术
- 金属基纳米复合材料脉冲电沉积制备技术
- 金属基镶嵌式固体自润滑轴承
- 金属壳体干燥室
- 金属复合材料中国制造20年
- 金属复合板
- 金属复合燃料电池
- 金属多孔材料国家重点实验室(西北有色金属研究院)
- 金属学
- 金属家具——材料的魅力:当代家具设计
- 金属家具通用技术条件
- 金属屋面
- 金属屑压块机
- 中国运用现代集成制造技术改造传统产业的经验和前景
- 有线电视广播系统运行维护规程编制情况和宣贯要点
- 伊和乌素风电厂35kv配电室火灾应急处理演练方案
- 基于风险接受准则的建筑工程风险评价和决策方法
- 有限元和有限层元横向同性土对建筑物沉降的影响
- 医药工业空调带转轮热回收装置的工程设计和节能分析
- 植被混凝土在水利边坡工程中进展和应用现状
- 在市中心紧邻地铁和保护建筑的大型深基坑设计与施工
- 政府和社会资本合作(PPP)项目专项债券发行指引
- 应用TAT和SATWE对钢筋混凝土框剪结构
- 中国水利经济会在山西举办水利经济和财务培训
- 智能点型离子感烟探测器和普通感烟探测器有什么区别
- 中华人民共和国房屋建筑和市政工程标准施工招标文件
- 云计算模型在船体复杂结构件装配和三维建模中的应用
- 振动沉管CFG桩复合地基在饱和软土地基工程的应用
- 制冷和空调设备运行与维修专业教学模式的创新与实践