减极性
变压器的一次绕组的电流P1进,P2出时,一次绕组上的外加电动势与自感电动势相同,P1为 ,P2为-;再说二次:这时的二次侧为K1流出,K2流入,说明二次绕组的感应电动势是K1为 ,K2为- 。
这样,P1与K1都在感应电动势上为 ,我们称它们为同名端。 即当从一侧的参考正极通入交流电流时,同时在另一侧绕组中产生感应电势,若另一侧绕组外部端子接有负载或短接,将有电流从另一侧绕组的参考极性端流出,从非参考极性端返回,两侧绕组电流所产生的磁势相减,此为减极性。
再说加极性和减极性:二节干电池串联时(手电筒) - 相接时电压相加, 相接时电压相减,这点应该明白?变压器也是同样,根据感应电动势的 - 极性,同名端相接(串联)为减极性,异名端相接为加极性。2100433B
减极性造价信息
减极性常见问题
-
电压互感器(PT)和电流互感器(Ct)是电力系统重要的电气设备,它承担着高、低压系统之间的隔离及高压量向低压量转换的职能。其接线的正确与否,对系统的保护、测量、监察等设备的正常工作有极其重要的意义。在...
-
一、指代不同1、单极性PWM调制:单极性PWM就是PWM波形在半个周期中只在单极性范围内变化。2、双极性PWM调制:双极性PWM就是PWM波形在半个周期中有正、有负。二、原理不同1、单极性PWM调制:...
减极性文献

 电流互感器(加极性、减极性)相关知识
电流互感器(加极性、减极性)相关知识
极性标志有加极性和减极性,常用的电流互感器一般都是减极性,即当使一次电流自 L1 端流向 L2。时,二次电流自 K1 端流出 经外部回路到 K2。L1 和 K1, L2 和 K2 分别为同极性端。 反之,就是加极性。 低压电流互感器实用技术问答 1 .电流互感器铭牌上额定电流比的含义是什么? 答:额定电流比系指一次额定电流与二次额定电流之比。 通常用不约分的分 数表示。所谓额定电流就是在这个电流下互感器可以长期运行而不会同发热损 坏。 2 .何为电流互感器的准确等级? 答:电流互感器变换电流存在着一定的误差, 根据电流互感器在额定工作条 件下所产生的变比误差规定了准确等级。 0.l 级以上电流互感器主要用于试验, 进行精密测量或者作为标准用来校验低等级的互感器, 也可以与标准仪表配合用 来校验仪表,常被称为标准电流互感器; 0.2级和 0.5级常川来连接电气计量 仪表; 3

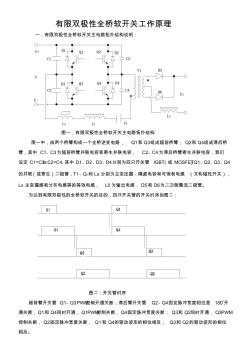 有限双极性软开关工作原理
有限双极性软开关工作原理
有限双极性全桥软开关工作原理 一,有限双极性全桥软开关主电路拓扑结构说明: 图一,有限双极性全桥软开关主电路拓扑结构 图一中,由两个桥臂构成一个全桥逆变电路, Q1和 Q3组成超前桥臂; Q2和 Q4组成滞后桥 臂,其中 C1﹑C3为超前桥臂并联电容和寄生并联电容, C2﹑C4为滞后桥臂寄生并联电容,我们 设定 C1=C3≥C2=C4,其中 D1﹑D2﹑D3﹑D4分别为四只开关管 IGBT(或 MOSFET)Q1﹑Q2﹑Q3﹑Q4 的并联(或寄生)二极管,T1﹑CB和 Ls 分别为主变压器﹑隔直电容和可饱和电感 (又称磁性开关), Lx 主变漏感和分布电感等的等效电感, L0为输出电感, D5和 D6为二次侧整流二极管。 为达到有限双极性的全桥软开关的目的,四只开关管的开关时序如图二: 图二:开关管时序 超前臂开关管 Q1﹑Q3 PWM控制开通关断;滞后臂开关管 Q2﹑Q4固定脉冲宽度相位
一个共价分子是极性的,是说这个分子内电荷分布不均匀,或者说,正负电荷中心没有重合。分子的极性取决于分子内各个键的极性以及它们的排列方式。在大多数情况下,极性分子中含有极性键,非极性分子中含有非极性键或者极性键。
然而,非极性分子也可以全部由极性键构成。只要分子高度对称,各个极性键的正、负电荷中心就都集中在了分子的几何中心上,这样便消去了分子的极性。这样的分子一般是直线形、三角形或四面体形。
分子极性对性质的影响:
极性判定标准
对于分子极性大小,尚无一个公认准确的量化标准,但比较常用的是根据物质的介电常数(尤其是液体和固体),对于一些简单的分子也可以根据其本身结构判断其是否有极性(如二氧化碳为直线型分子,为非极性化合物,但二氧化硫分子结构为V字型,故为极性分子)。
极性溶解性
分子的极性对物质溶解性有很大影响。极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂,也即“相似相溶”。氨等极性分子和氯化钠等离子化合物易溶于水。具有长碳链的有机物,如油脂、石油(不一定是非极性分子)的成分多不溶于水,而溶于非极性的有机溶剂。
极性熔沸点
在分子量相同的情况下,极性分子比非极性分子有更高的沸点。这是因为极性分子之间的取向力比非极性分子之间的色散力大。
极性应用
通常分子极性可以用于物质的柱色谱分析和物质结晶分离,对于通常的实验来说:常见的溶剂极性大小顺序(由小至大)为:
石油醚、环己烷、四氯化碳、苯、甲苯、二氯乙烷、二氯甲烷、三氯乙烯、二苯醚、氯仿、正丁醚、乙醚、DME、硝基苯、二氧六环、三辛胺、四氢呋喃、乙酸乙酯、三丁胺、甲酸甲酯、三乙胺、丙酮、苯甲醇、吡啶、正丁醇、异丙醇、乙二醇、乙醇、乙酸、甘油(丙三醇)、乙腈、DMF、甲醇、六甲基磷酰胺、甲酸、DMSO、三氟乙酸、甲酰胺、水、三氟甲磺酸、无水硫酸、无水高氯酸、无水氢氟酸。
其中三氟乙酸,三氟甲磺酸,无水硫酸、无水高氯酸、无水氢氟酸等强酸由于腐蚀性极强,实际上在一般实验中应用不多,这里只是列出以便比较物质极性大小而已,通常柱色谱常用有机溶剂为石油醚、环己烷、二氯甲烷、三氯乙烯、乙醚、DME、二氧六环、四氢呋喃、乙酸乙酯、丙酮、乙醇、乙酸、甲醇这几种溶剂,至于具体问题,则经常使用几种溶剂的混合溶剂来进行分离物质。
物质结晶分离时通常将极性不同的溶剂加入溶液中,使得所需要物质结晶析出,最常见的即是摩尔盐和蓝矾的合成中加入乙醇使得二者析出(二者均难溶于乙醇)。至于有机物的重结晶则不胜枚举(例如咖啡因的重结晶时向其乙醇溶液中加入水使其结晶析出。
极性键与非极性键
首先化学共价键分为极性键与非极性键。非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl 。
极性分子与非极性分子
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性。
对于H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂。
化合物的极性决定于分子中所含的官能团及分子结构。各类化合物的极性按下列次序增加:
-CH3,-CH2-,-CH=,-C三,-O-R,-S-R,-NO2,-N(R)2,-OCOR,-CHO,-COR,-NH2, -OH,-COOH,-SO3H
指细胞、细胞群、组织或个体所表现的沿着一个方向的,各部分彼此相对两端具有某些不同的形态特征或者生理特征的现象。
关于形态上的极性,例如在腺上皮细胞中,核的位置靠近基部,中心体的位置靠近表面;在两栖类的成熟卵中,核靠近动物极,表层色素层分布在动物半球,卵黄粒多在植物半球等。
关于在生理上和细胞化学上的极性,如卵细胞质内的氧化还原能、氧的消耗、SH基、核糖核酸浓度的梯度等。
在形态形成中,极性在动态的意义上比较更具有重要的作用。例如,涡虫的切断体进行再生时,从朝向原来前端的断面上再生出头部,从朝向原来后端的断面上再生出尾部。水螅水母类的分离块往往显示出前后的极性,从前端再生出水螅体,从后端再生出螅茎。
卵的极性与由其所形成的胚的形态轴有密切的关系(参见卵轴)。有时还出现细胞的极性受细胞内外环境影响的现象。例如,墨角藻属的卵细胞,其极性可为pH的梯度、温度的梯度、光的照射等所左右。还有许多无脊椎动物的卵,其极性是在卵形成时,由卵细胞和卵单壁所处的位置而定的。
- 相关百科
- 相关知识
- 相关专栏
- 减震器活塞杆用钢
- 定位基准
- 凝结水精处理
- 凝结水精处理用离子交换树脂
- 凝结水精处理覆盖过滤器滤元
- 定型枕
- 定子铁心故障检测仪
- 凤凰印象装饰设计有限责任公司
- 东贝机电(江苏)有限公司
- 凤台县盛世永强实业有限公司
- 凤城市住房和城乡建设局
- 凤庆冬青
- 凤泉明科振动电机
- 东方电机厂
- 东方电机工模具有限公司
- 东方电机控制设备有限公司
- 有限双极性软开关PWM控制和IGBT驱动电路设计
- 孤山川流域已有水土保持措施蓄水减沙效益计算成果分析
- 构皮滩发电厂技术供水系统减压阀改造应用
- 广州大学机械设计一级齿轮减速器设计书(2600)
- 基于FlAC3D强度折减法露天煤矿边坡稳定性分析
- 机械设计基础课程设计一级圆柱齿轮减速器设计说明书
- 基于ABAQUS强度折减法边坡稳定性影响因素分析
- 冷弯薄壁卷边槽钢偏心受压构件承载力计算折减强度法
- 利用空心连铸管坯减径轧制生产中小直径无缝钢管方法
- 基于AMESimCNG发动机高压减压阀建模与分析
- 模板工程使用低质素面木胶合模板有违节能减排目标
- 江苏省节能减排(建筑节能)专项引导资金管理暂行办法
- 加新与减旧沈阳铁西区工业建筑改造中两种艺术手法
- 极低屈服点钢阻尼耗能减震器在钢结构建筑中应用技术
- 减速器装配图CAD
- 减震爆破技术在南阳渠总干5A标水工隧洞施工中应用