化合价升降配平法练习题
试配平下列氧化还原反应方程式:
1. P CuSO4 H2O─Cu3P H3PO4 H2SO4 (提示:逆向配平)
2. Fe3C HNO3─Fe(NO3)3 CO2↑ NO2↑ H2O(提示:可令C为 4价,则Fe为 8/3价)
3. CH≡CH KMnO4 H2SO4─HCOOH MnSO4 K2SO4 ___
4. RxO42- MnO4- H ─RO2 Mn2 H2O
(答案)
1. 11、15、24、5、6、15
2. 1、22、3、1、13、11
3. 5、6、9、10、6、3、4H2O
4. 5、(4X-6)、(12X-8)、5X、(4X-6)、(6X-4)
化合价升降配平法造价信息
1.一般化学方程式的配平
例:
1 -2 5 2 2 6
Cu2S HNO3—Cu(NO3)2 NO↑ H2SO4 H2O
【分析】从化合价的变化可知,Cu2S为还原剂,HNO3为氧化剂,氧化剂、还原剂不属于同一种物质,应正向配平,以正向变价元素的原子个数为准来表示价态变化。Cu2S中两个 1价的Cu变为两个 2价的Cu化合价升高了2,一个-2价的S变为一个 6价的S化合价升高了8,共升高了10;而在HNO3中,一个 5价的N变为 2价的N化合价降低了3。求最小公倍数使化合价升降总数相等,则Cu2S的系数为3,HNO3的系数为10。这一过程可直观的表示为(“↑“表示化合价的升高,“↓“表示化合价的降低,对应“ד前的数值;“ד后的数值表示含变价元素物质的系数。下同) 1 2 2Cu→2Cu ↑2 -1 6 ↑10×3
S→S ↑8
5 2
N→N ↓3×10
所以Cu2S的系数为3,HNO3的系数为10,进而确定氧化产物Cu(NO3)2、H2SO4的系数分别为6和10;再根据质量守恒定律配平其它物质的系数得(注:要把未变价的HNO3加上):
3Cu2S 22HNO3 =6Cu(NO3)2 10NO↑ 3H2SO4 8H2O
2.氧化还原反应离子方程式的配平
可先根据化合价升降相等配平含变价元素物质的系数,再根据电荷守恒、质量守恒配平其它物质的系数。
例:
7 4 6
MnO4- SO32- H ─Mn2 SO42- H2O
【分析】从化合化变化可知:氧化剂、还原剂不属于同一种物质,应正向配平。则:
7 2
Mn→Mn↓5×2
4 6
S→S↑2×5
可确定的MnO4- SO32- Mn2 SO42- 系数分别为2、5、2、5;进而根据电荷守恒确定H 的系数为6,最后根据质量守恒确定H2O的系数为3,即:
2MnO4- 5SO32- 6H ═2Mn2 5SO42- 3H2O
3.缺项方程式的配平
所谓缺项方程式,即某些反应物或生成物在方程式中未写出,它们一般为水、酸、碱。配平方法是:先根据化合价升降法配平含变价元素物质的系数,再通过比较反应物和生成物,观察增减的原子或原子团来确定未知物,然后根据质量守恒进行配平。
例:
-1 3 6 -2
H2O2 Cr2(SO4)3 __——K2SO4 K2CrO4 H2O
【分析】从化合价变化可知:氧化剂、还原剂不属于同一种物质,应正向配平。则:
-1 -2
2O→2O ↓2×3
3 6
2Cr →2Cr ↑6×1
初步配平可得:3H2O2 Cr2(SO4)3 □─3K2SO4 2K2CrO4 H2O
因为方程式右边有K ,所以左边反应物中必有K ;而K 在水、酸、碱三类物质中只可能在碱KOH中,故所缺物质为KOH;再根据质量守恒配平其它物质的系数得: 3H2O2 Cr2(SO4)3 10KOH═3K2SO4 2K2CrO4 8H2O
化合价升降配平法基本步骤
标变价=>列变化=>求总数=>配系数=>查守恒
一、标变价:写出反应物和生成物的化学式,标出变价元素的化合价。
二、列变化:列出反应前后元素化合价的升、降变化值。
三、求总数:使化合价升高和降低的总数相等。
四、配系数:用观察的方法配平其他物质的化学计量数,配平后,把单线改成等号。
五、查守恒:检查方程式两边是否“质量守恒”和“电荷守恒”。
在配平时,是先考虑反应物,还是先考虑生成物,一般有如下规律:
⒈若氧化剂和还原剂中某元素的化合价全部改变,配平宜从氧化剂、还原剂开始,即先考虑反应物。(正向配平)
⒉若氧化剂(或还原剂)中某元素化合价只有部分改变,配平宜从氧化产物、还原产物开始,即先考虑生成物。(逆向配平)
⒊自身氧化还原反应方程式,宜从生成物开始配平。(逆向配平)
⒋同一反应物中有多种元素变价,可将该物质作为一个整体考虑,即求该物质的一个分子中各变价元素的化合价升、降值的代数和。
化合价升降配平法配平方法
氧化还原反应方程式的配平方法有:化合价升降法、离子-电子法、待定系数法等;配平技巧有:零价配平法、平均标价法、化整为零法、整体分析法等等。
为使同学们快速灵活地运用“化合价升降法“配平氧化还原反应方程式,本文介绍如下,希望对大家有所启发。
①零价法
用法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降值相等,最后用观察法配平其他物质的化学计量数。 试配平 Fe3C HNO3 - Fe(NO3)3 NO2 CO2 H2O。
分析:复杂物质Fe3C按常规化合价分析无法确定其中Fe和C的具体化合价,此时可令组成该物质的各元素化合价均为零价,再根据化合价升降法配平。
Fe3C → Fe(NO3)3 和 CO2 整体升高13价,HNO3 → NO2 下降1价(除了Fe、C以外,只有N变价)。易得 Fe3C 22HNO3 = 3Fe(NO3)3 13NO2 CO2 11H2O。
②平均标价法
用法:当同一反应物中的同种元素的原子出现两次且价态不同时,可将它们同等对待,即假定它们的化合价相同,根据化合物中化合价代数和为零的原则予以平均标价,若方程式出现双原子分子时,有关原子个数要扩大2倍。
试配平 NH4NO3- HNO3 N2 H2O。
【分析】NH4NO3中N的平均化合价为 1价,元素化合价升降关系为:
NH4NO3 → HNO3: 1→ 5 升4×1价
NH4NO3 → N2: 1→0 降1×2价
易得 5NH4NO3 = 2HNO3 4N2 9H2O
③整体标价法
用法:当某一元素的原子或原子团(多见于有机反应配平)在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零的原则予以整体标价。
试配平 S Ca(OH)2- CaSx CaS2O3 H2O
易得 2(x 1)S 3Ca(OH)2 = 2CaSx CaS2O3 3H2O
化合价升降配平法练习题常见问题
-
CAD图库 http://www.nashing.com/sd/thread.php?fid=16 平面图、立面图、大样图、整套施工图都有的,可以通过审核的会员登陆下载,或通过临时会员帐号下载,获取临...
-
新干线上很多,你可以去下载的吗
-
集团公司大量的工程审计业务,使内部审计人员措手不及,再加上是非工程专业人员,更是困难重重,为此,整理一些与工程审计有关有资料,以有所帮助。 现行工程造价构成总览 * 3)工程建设其他费用=土地使用费+...
一、反应前后各元素的原子个数相等,即质量守恒。
二、氧化剂得电子总数与还原剂失电子总数相等,即电子守恒。
三、氧化剂化合价降低的总数值与还原剂化合价升高的总数值相等。
化合价升降配平法练习题文献

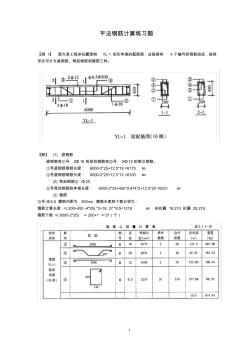 平法钢筋计算练习题
平法钢筋计算练习题
1 平法钢筋计算练习题 【例 1】 图为某工程非抗震预制 YL-1 矩形单梁的配筋图,这根梁有 4 个编号的钢筋组成,按其 形状可分为直钢筋、弯起钢筋和箍筋三种。 【解】 (1) 直钢筋 直钢筋有①号 2Φ18 的受拉钢筋和③号 2Φ12的架立钢筋。 ①号直钢筋钢筋长度: 6000-2*25+12.5*18 =6175 ㎜ ③号直钢筋钢筋长度: 6000-2*25+12.5*12 =6100 ㎜ (2) 弯起钢筋② Φ20 ②号弯起钢筋的单根长度: 6000-2*25+400*0.414*2+12.5*20 =6531 ㎜ (3) 箍筋 ④号Φ6.5 箍筋问距为 200mn,箍筋长度和个数分别为: 箍筋计算长度 =( 200+450 -4*25) *2+18. 27 *6.5=1219 ㎜ 非抗震 18.27d 抗震 28.27d 箍筋个数 =( 6000-2*25) ÷ 200

 学会根据化合价写出常见化合物的化学式.
学会根据化合价写出常见化合物的化学式.
【本讲教育信息 】 一. 教学内容: 学会根据化合价写出常见化合物的化学式 二. 重点、难点: 根据化合价书写化学式是重点 对化合价能写出化学式的理解是难点 三. 教学程序 根据下表中化合物的组成,写出它们的化学式 化合物名称 构成微粒 微粒个数比 化学式 二氧化碳 CO2 氧化钙 Ca2+、O2— 1:1 氢氧化钠 Na+、OH— 1:1 通过以上练习,大家会发现化合物中各种微粒在化合时有什么特点。 科学家们通过对大量化合物组成的研究发现,同一种化合物都有固定的组成 (一)化合价 化合价体现的是不同元素的原子相互化合时具有确定的原子个数比的性质。 常见元素的主要化合价见课本 P44表 2-5 中第一、二列 这些元素的化合价,需要我们认真记住! ! 化合价记忆口诀 一价氢氯钾钠银; 二价氧钡钙镁锌; 三价金属铁和铝; 四价碳硅五价磷; 二三铁;二四碳; 二四六硫都齐全; 铜汞二价最常见
- 相关百科
- 相关知识
- 相关专栏
- 化合物半导体材料
- 化学仪器
- 化学品柜
- 化学工业标准汇编。涂料与颜料。2003.下
- 化学工业标准汇编:无机化工产品
- 化学检验员(供水)基础知识与专业实务
- 化学气相沉积反应炉中的排气歧管
- 化学灭火
- 化学热力学及其在材料学中的应用
- 化学热学
- 化学玻璃
- 化学试剂标准玻璃乳浊液和澄清度标准
- 化学进展丛书:结构材料化学进展
- 化州中燃城市燃气发展有限公司
- 化州市工程建设监理有限公司
- 化工产品手册·树脂与塑料
- 正交法在沙坪水电站工程泵送混凝土配合比设计的应用
- 永嘉碧桂园翡翠郡附着式升降脚手架安全专项施工方案
- 整体顶升法在300t网架结构屋盖改造工程中的应用
- 以电动葫芦为起升机构的简易强制式升降机钢丝绳检验
- 旋喷搅拌喷射钻具及土体支护施工工法专利申请书
- 招投标法实施细则(20200812162626)
- 有限元法在复杂水工结构变形分析及配筋计算中的应用
- 增加托架法在铁路桥梁大宽度人行道托架加固中的应用
- 振冲法在西安市第三污水处理厂地基处理工程中的应用
- 中华人民共和国反不正当竞争法不正当竞争行为
- 与主体结构同步施工的现浇剪力墙外墙外保温施工工法
- 增量法在改扩建和技术改造项目经济评价中的具体应用
- 优化EMD法及其在航空发动机振动信号分析中的应用
- 工艺工法建筑工程砌体工程施工工艺及质量验收标准
- 根据中华人民共和国合同法、中华人民共和国政府
- 工艺工法预应力弦支穹顶结构施工工法