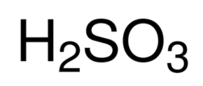h2so3
H₂SO₃即亚硫酸。无色透明液体,具有二氧化硫的窒息气味,易分解;;溶于水;相对密度(水=1)1.03;相对密度(空气=1)2.8;稳定性:稳定;危险标记:20(酸性腐蚀品);主要用途:用作分析试剂、还原剂及防腐剂。健康危害:对眼睛、皮肤、粘膜和呼吸道有强烈的刺激作用。吸入后可因喉、支气管的痉挛、水肿、炎症、化学性肺炎、肺水肿而致死。中毒表现有烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐。
h2so3基本信息
| 中文名称 | 亚硫酸 | 化学式 | H₂SO₃ |
|---|---|---|---|
| CAS登录号 | 7782-99-2 | 外观 | 无色透明液体 |
| 密度 | 1.03g/mL3 | 分子量 | 82.0791 |
| 酸性 | 中强酸 | 英文名 | Sulfurous acid |
| 别称 | 亚硫酸酐溶液 | 应用 | 分析试剂、还原剂及防腐剂 |
| EINECS登录号 | 231-973-1 | ||
二氧化硫溶于水所形成的二氧化硫水合物SO2·хH2O被称作亚硫酸。溶液中不存在亚硫酸分子H2SO3。亚硫酸是二元中强酸,一般做弱酸处理,属于弱电解质。亚硫酸为酸雨的组成物质。
h2so3造价信息

h2so3基本信息
中文名称:亚硫酸
中文别名:二氧化硫溶液;亚硫酸酐溶液;二氧化硫6%水溶液
英文名称:Sulfurous acid
英文别名:schwefligesaure; sulfurdioxidesolution; sulfurous;
SULPHUROUS ACID; SULFUROUS ANHYDRIDE; Sulfur dioxcide solution; sulfonic acid
CAS:7782-99-2
EINECS:231-973-1
分子式:H2So3
分子量:82.0791
安全说明: S26:万一接触眼睛,立即使用大量清水冲洗并送医诊治。
S45:出现意外或者感到不适,立刻到医生那里寻求帮助(最好带去产品容器标签)。
S36/37/39:穿戴合适的防护服、手套并使用防护眼镜或者面罩。
危险类别码: R20:吸入有害。
R34:会导致灼伤。
h2so3常见问题
-
先加SO2然后变成NaHSO3,然后蒸干灼烧就变成了Na2SO4
-
V=(a+2c+K*H)*(b+2c+K*H)*H+1/3*K2*H3不懂
你的理解是错的,因为前面的公式有个H3K2已经抵消了,所以就剩1/3了 你直接这么算就知道了(b+2c)*(a+2c)*H+(a+2c)*H*KH+(b+2c)*H*KH+KH*KH*H*4/3合并这...
-
球冠体积公式到底是(1/3)π(3R-h)*h^2 还是 π(h*h)(R-h/3),啊
球体的。公式是第二个。
有害物成分 含量 CAS No.
亚硫酸94.0% 7782-99-2
二氧化硫的水溶液叫做亚硫酸.
实际上它是一种水合物SO2·xH2O。2012不仅没有制得游离的亚硫酸.
而且当它存在于水溶液中时?已显著地分解为SO2和H2O。
在亚硫酸的水溶液中存在下列平衡: SO2+xH2O == SO2·xH2O == H++HSO +(x+1)H2O K1=1.54×10^2(291K) HSO3-== H++SO32- K2=1.02×10^7(291K)
加酸并加热时平衡向左移动?有SO2气体逸出。
加碱时,则平衡向右移动,生成酸式盐或正盐。 NaOH+SO2===NaHSO3?2NaOH+SO2===Na2SO3+H2O
在亚硫酸和亚硫酸盐中?硫的氧化数为+ⅠV?
所以亚硫酸和亚硫酸盐既有氧化性?又有还原性?但它们的还原性是主要的。亚硫酸盐比亚硫酸具有更强的还原性。 碱金属的亚硫酸盐易溶于水?由于水解?溶液显碱性?其他金属的正盐均微溶于水?而所有的酸式亚硫酸盐都易溶于水。亚硫酸盐受热容易分解。
如?4Na2SO3===3Na2SO4+Na2S亚硫酸盐或酸式亚硫酸盐遇到强酸即分解?放出SO2?这也是实验室制取少量SO2的一种方法。
亚硫酸盐有很多实际用途?例亚硫酸氢钙大量用于造纸工业?即用它溶解木质制造纸浆?亚硫酸钠和亚硫酸氢钠大量用于染料工业?也用作漂白织物时的去氯剂?反应如下?
H2O+SO +Cl2===SO +2Cl?+2H+ 另外?农业上使用亚硫酸氢钠作为抑制剂?促使水稻、小麦、油菜、棉花等农作物增产?这是由于NaHSO3能抑制植物的光呼吸?从而提高净光合所致
系6%二氧化硫水溶液。有二氧化硫窒息气味。不稳定、易分解。有还原性,在空气中渐氧化成硫酸而降低含量
用作分析试剂、防腐剂、漂白剂及还原剂。用于有机合成
具有酸的通性,具有硫酸的部分性质,与碳酸最为相似。酸性比碳酸强
亚硫酸的还原性
亚硫酸与卤素反应:
H2SO3 +X2 +H2O ===H2SO4 +2HX
与氧反应
2H2SO3 + O2 === 2H2SO4
H2SO3 +常见氧化剂(如H2O2)→H2SO4
危险性类别: 8类危险品,酸性腐蚀品。
侵入途径:
健康危害: 对眼睛、皮肤、粘膜和呼吸道有强烈的刺激作用。吸入后可因喉、支气管的痉挛、水肿、炎症,化学性肺炎、肺水肿而致死。中毒表现有烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐。
环境危害: 对环境有危害,对水体可造成污染。
燃爆危险: 本品不燃,具强腐蚀性、强刺激性,可致人体灼伤。
皮肤接触: 立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
眼睛接触: 立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入: 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入: 用水漱口,给饮牛奶或蛋清。就医。
危险特性: 暴露在空气中可发生氧化反应生成硫酸。受高热分解产生有毒的硫化物烟气。具有腐蚀性。
有害燃烧产物:二氧化硫。
灭火方法: 灭火剂:雾状水、二氧化碳、砂土。
应急处理: 迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。不要直接接触泄漏物。尽可能切断泄漏源。小量泄漏:将地面洒上苏打灰,然后用大量水冲洗,洗水稀释后放入废水系统。大量泄漏:构筑围堤或挖坑收容。用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
操作注意事项: 密闭操作,注意通风。操作尽可能机械化、自动化。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩),穿橡胶耐酸碱服,戴橡胶耐酸碱手套。防止蒸气泄漏到工作场所空气中。避免与碱类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项: 储存于阴凉、通风的库房。远离火种、热源。包装要求密封,不可与空气接触。应与碱类分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。
职业接触限值
中国MAC(mg/m3): 未制定标准
前苏联MAC(mg/m3): 未制定标准
TLVTN: 未制定标准
TLVWN: 未制定标准
监测方法:
工程控制: 密闭操作,注意通风。尽可能机械化、自动化。提供安全淋浴和洗眼设备。
呼吸系统防护: 可能接触其烟雾时,佩戴自吸过滤式防毒面具(全面罩)或空气呼吸器。紧急事态抢救或撤离时,建议佩戴氧气呼吸器。
主要成分: 含量: 94.0%; 约含6%二氧化硫水溶液。
外观与性状: 无色透明液体,具有二氧化硫的窒息气味,易分解。
pH:pH <7
熔点(℃): 无资料
沸点(℃): 无资料
相对密度(水=1): 1.03
相对蒸气密度(空气=1): 2.8
饱和蒸气压(kPa): 无资料
临界温度(℃): 无资料
临界压力(MPa): 无资料
辛醇/水分配系数的对数值: 无资料
溶解性: 溶于水。
电离常数:K1= 0.012 mol/L;K2=6.6×10^-8 mol/L。
主要用途: 用作分析试剂、还原剂及防腐剂。
其它理化性质:在30℃时,水能溶解28倍体积的SO2,饱和溶液含二氧化硫8%,浓度达到1.25mol/L,电离超过10%,产生氢离子0.13mol/L,PH=0.89,酸性较强。亚硫酸是化学式为H2SO3的无机化合物,通常指二氧化硫的水溶液。真正的亚硫酸分子只在气态有发现,溶液中的尚未观测到。对应的正盐为亚硫酸盐,酸式盐为亚硫酸氢盐。根据拉曼光谱的数据,二氧化硫的水溶液中存在的全部是二氧化硫分子及亚硫酸氢根离子,与下列平衡有关:SO2 + H2O ? HSO3-+ H+
pKa1= 1.81,而磷酸的pKa1只有2.12(越小酸性越强),所以亚硫酸也属于中强酸,而非弱酸。
稳定性: 不稳定常温下即可分解
禁配物: 强碱。
避免接触的条件: 在空气中可被氧化。
聚合危害:
分解产物: 水,二氧化硫
生态毒理毒性:
生物降解性:
非生物降解性:
生物富集或生物积累性:
其它有害作用: 该物质对环境有危害,应特别注意对水体的污染。亚硫酸可以破坏大理石等,是酸雨的主要组成部分。
废弃物性质:
废弃处置方法: 根据国家和地方有关法规的要求处置。或与厂商或制造商联系,确定处置方法。
废弃注意事项:
法规信息化学危险物品安全管理条例(1987年2月17日国务院发布),化学危险物品安全管理条例实施细则 (化劳发[1992] 677号),工作场所安全使用化学品规定 ([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用危险化学品的分类及标志 (GB 13690-92)将该物质划为第8.1 类酸性腐蚀品。
h2so3文献

 PVC膜改性助剂PVDF/PS-SO_3H/GMS的制备
PVC膜改性助剂PVDF/PS-SO_3H/GMS的制备
将聚偏氟乙烯(PVDF)和阳离子交换树脂(PS-SO3H)、单甘酯(GMS)以适当的比例充分混合均匀,经造粒机挤出即得到新型PVC膜改性助剂。最佳工艺条件为:配比PVDF/PS-SO3H/GMS为82∶14∶4,用于PVC膜混合料,PVC树脂/PVC膜改性助剂的最佳配比为85∶15,加入膜改性助剂后,膜制品的透水率得到提高,力学性能也有所改善。

 H_2O_2/H_2SO_4法溶解不锈钢铜包套的新方法
H_2O_2/H_2SO_4法溶解不锈钢铜包套的新方法
介绍了一种用 H2 O2 /H2 SO4溶解不锈钢铜包套的新方法 ,对温度、稳定剂以及各种原料的浓度等影响因素进行了讨论。传统方法大多以硝酸为主要成分 ,在溶解过程中放出有毒的NOX,严重污染环境。本方法无此弊端 ,对保护环境具有重要意义
样品→酸化H+→通气(空气和氯气)→加热→双层冷凝管(可排除有机酸与挥发酸的干扰)→SO2→通过吸收液H2O2→H2SO3→氧化→H2SO3→(1)中和法测定;(2)重量法测定。
美国分析法
样品→酸化→蒸馏→SO2→通过吸收液H2O2→H2SO3→氧化→H2SO3→(1)中和法测;(2)重量法测
日本采用双层冷凝管可排除有机酸和挥发性物的干扰,有的科研单位,也有用通气法测SO2,但是比较简单,主要是一些挥发性气体与有机物全都在里面,不能排除干扰,误差较大,所以采用比色法测定SO2的残留量,而美国采用酸化蒸馏后用中和法测SO2,与讲义上的中和滴定法一样。
中和滴定法
原理:亚硫酸盐在酸性条件下加热,蒸出二氧化硫,然后用双氧水溶液吸收并氧化成硫酸,再用标准碱溶液滴定至终点橄榄色,然后根据消耗碱液计算出样品中SO2的含量。为什么不采用中和滴定法作为国标,而是采用比色法为国标,且比色法中四氯汞钠又有毒性,这主要是因为中和法测SO2在样品处理时较麻烦,而且要通入N2,条件比较苛刻,所以采用比色法测定SO2,且准确度也较高。
1、 反应方程式脱硫塔是烟气脱硫和产生硫酸氨盐的中间装置。烟气中的SO2在脱硫塔中被除去,脱硫塔中是PH值控制为5.05.9的饱和硫酸氨/亚硫酸氨溶液,与SO2的反应,按照下列反应生成亚硫酸氢氨/硫酸氢盐:1) SO2 H2OH2SO32) H2SO3 (NH4)2 SO4NH4HSO4 NH4HSO33) H2SO3 (NH4)2 S O32NH4HSO3在反应(1)中,烟气中的溶于水中生成亚硫酸。在反应(2)和(3)中,亚硫酸与该溶解的硫酸氨/亚硫酸盐反应。喷射到反应池底部的氨水,按如下方式中和酸性物:4) H2SO3 NH3NH4SO35) NH4HSO3 NH3NH4HSO4 NH4HSO36) H2SO3 NH3(NH4)2 SO4喷射到脱硫塔底部的氧化空气,会按照如下方式将亚硫酸盐氧化为硫酸盐:(NH4)2 SO3 1/2 O2(NH4)2 SO4至此,锅炉脱硫除尘器的脱硫塔中生成了大量的硫酸氨,硫酸按溶液饱和后,使硫酸氨从溶液中以结晶形状沉淀出来。汽化热由烟气的残余热量按照如下方式提供:(NH4)2 SO4(液态) 汽化热>(NH4)2 SO4(固体)脱硫塔中的盐要么以离子形式溶于溶液中,要么以结晶形状沉淀出来。产品浆液与正在进行化合的系统中的主要成分、结晶的硫酸氨盐一起充分地氧化。
化学名称:十八烷基二甲基羟丙基磺基甜菜碱
化学结构:C18H37N(CH3)2CH2CH(OH)CH2SO3
- 相关百科
- 相关知识
- 相关专栏
- 3dsmax中文版
- 油漆纸
- 自清洗过滤器
- 离核毛桃
- 漳州站
- 塔填料
- 紫叶桃花
- 蒸馏器
- 羰基铁粉
- 凝胶层析
- 载货电梯
- Zeta电位仪
- Zeta电位分析仪
- 静电发电机
- 环锤式破碎机
- 能量收集技术(Energy Harvesting Technologies)
- 基于压电堆驱动器的喷嘴挡板式气体控制阀
- 电气工程及其自动化特色专业建设探索
- 分形DGS单元结构设计及其在微带电路中的应用
- 磷铵技术改造五大磷肥工程的建议
- 以大豆油多元醇制备的硬质聚氨酯泡沫塑料的性能
- 逆变TIG焊机接触引弧电路的设计(引弧电路)
- 预制砌块(砖、石)挡土墙工程砌体施工安全技术交底
- 应用模糊数学理论对公路工程建设项目方案的综合评价
- 引嫩工程扩建区土壤水盐动态与防治土壤盐碱措施
- 中华华丹雨、污水管道沟槽开挖专项施工方案教学教材
- 中国工程图学学会成立工程与制造系统集成化分会
- 中国吹制玻璃行业市场前景分析预测年度报告(目录)
- 可替代现有隔热保温材料的新型材料
- 医院病房楼工程施工装饰装修工程施工控制
- 在生活中构筑自然——河南天旺园林工程有限公司剪影
- 中国机械工程学会授予材料热处理工程师资格人员名单