氟氩化氢基本信息
IUPAC名 Argon fluorohydride | |
别名 | 氩氟化氢、氢氟化氩 |
识别 | |
CAS号 | 163731-16-6 |
性质 | |
化学式 | HArF |
摩尔质量 | 59.954 g·mol |
外观 | 未知 |
密度 | 未知 |
熔点 | −256°C (分解) |
溶解度(水) | 未知(氢氟氩酸饱和浓度) |
氟氩化氢造价信息
经过红外光谱术分析后,他们发现氩原子已经和氟原子、氢原子产生化学键,但该化学键非常的弱,只要温度高于−256°C它就会再分解为氩和氟化氢。
芬兰赫尔辛基大学的科学家在24日出版的英国《自然》杂志上报告说,他们首次合成了惰性气体元素氩的稳定化合物--氟氩化氢,分子式为HArF。
这样,6种惰性气体元素氦、氖、氩、氪、氙和氡中,就只有原子量最小的氦和氖尚未被合成稳定化合物了。惰性气体可广泛应用于工业、医疗、光学应用等领域,合成惰性气体稳定化合物有助于科学家进一步研究惰性气体的化学性质及其应用技术。
在惰性气体元素的原子中,电子在各个电子层中的排列,刚好达到稳定数目。因此原子不容易失去或得到电子,也就很难与其它物质发生化学反应,因此这些元素被称为"惰性气体元素"。
在原子量较大、电子数较多的惰性气体原子中,最外层的电子离原子核较远,所受的束缚相对较弱。如果遇到吸引电子强的其他原子,这些最外层电子就会失去,从而发生化学反应。1962年,加拿大化学家首次合成了氙和氟的化合物。此后,氡和氪各自的化合物也出现了。
原子越小,电子所受约束越强,元素的"惰性"也越强,因此合成氦、氖和氩的化合物更加困难。赫尔辛基大学的科学家使用一种新技术,使氩与氟化氢在特定条件下发生反应,形成了氟氩化氢。它在低温下是一种固态稳定物质,遇热又会分解成氩和氟化氢。科学家认为,使用这种新技术,也可望分别制取出氦和氖的稳定化合物。
氟氩化氢(HArF)中氟为-1价,氩为0价,氟离子用配位键与氩原子连接。氟氩化氢很不稳定,但在固体状态是稳定化合物,在水或有机溶液中也比较稳定。HArF有酸性,[ArF]-离子也较稳定。HArF能和很多碱性物质反应,具有较强的酸性。如NaOH + HArF ==== Na[ArF](氟氩化钠) + H2O。
氟氩化氢基本信息常见问题
-
租售状态: 出售开 发 商: 北京天亚物业开发有限公司投 资 商: ----占地面积: 11800.00平方米总建筑面积: 100000.00平方米详细信息售 楼 处: 北京市朝阳区光华路嘉裹中心饭店...
-
四氟盘根四氟盘根由纯聚四氟乙烯纤维编织而成的,不经PTFE乳液及润滑油脂处理。因是由实心编织而具有柔韧可调性,所以与轴,填料箱能很好的配合有卓越的耐腐蚀性能,良好的自润滑性和防粘贴性。可用于化工、食品...
-
海棱香木,一种药用植物,有毒。最早载于中医著作《素问》及《难经》中。据载,此物原产于西牛贺州(佛教地名),每逢盛夏时节,香木中就会渗出白色乳状液体。当地人将液体晒干后磨制成白色粉末。这种白色粉末燃烧有...
水溶性:氢氟氩酸即氟氩化氢的水溶液。氟氩化氢在水中溶解度很大,和氢氟酸类似。但是氟氩配离子的碱性要远远小于氟离子。所以氢氟氩酸酸性比氢氟酸要强(和盐酸类似),[ArF]-离子在水溶液中很稳定,显氧化还原惰性。氢氟氩酸目前仅限于用作实验室的分析试剂,但如果可以大量合成氟氩化氢并将其溶于水制成氢氟氩酸,这将是一种良好的活泼金属溶剂(因为氢氟氩酸能够溶解很多诸如铅、钛等活动性排在氢前面,一般酸却很难溶解的金属。)
氟氩化氢气体在 −256℃即会分解,将其在低温状态下用液态氮溶解,再加入冰吸收,取出冰融化即得氢氟氩酸,氢氟氩酸的浓度一般在10%~20%左右,饱和浓度至今为止仍是个谜,但是有一点值得肯定,那就是氢氟氩酸比氟氩化氢气体稳定得多。但是若温度超过40K,HArF一样会发生爆炸性分解。
氟氩化氢基本信息文献

 建筑物基本信息
建筑物基本信息
建筑物基本信息 参数名 必填 描述 项目实际情况 建筑代码 数据中心代码 建筑名称 必填 最多24个汉字 建筑字母别名 必填 建筑首字母大写 建筑业主 必填 有多位业主时存主要业主名称,外加 “等××位” 建筑监测状态 状态 1- 启用监测 0- 停用监测 所属行政区划 必填 6位行政区划代码 建筑地址 必填 最多40个汉字 建筑坐标 -经度 建筑坐标 -纬度 建设年代 必填 4位数字年份 地上建筑层数 必填 整数 地下建筑层数 整数 建筑功能 必填 A- 办公建筑 B- 商场建筑 C- 宾 馆饭店建筑 D- 文化教育建筑 E- 医疗卫生建筑 F- 体育建筑 G- 综 合建筑 H- 其它建筑 建筑总面积 必填 空调面积 必填 采暖面积 必填 建筑空调系统形式 必填 A- 集中式全空气系统 B- 风机盘管 +新风系统 C- 分体式空调或 VRV的 局部式机组系统 Z

 塔吊基本信息
塔吊基本信息
一.塔吊的基本结构 塔吊从功能上看,可以分为七大部分:金属结构、零部件、工作 机构、电气设备、液压系统、安全装置和附着锚固。 塔吊金属结构由起重臂、塔身、转台、承座、平衡臂、底架、塔 尖等组成。 塔吊零部件则由钢丝绳(起吊的主要受力部件) 、变幅小车(车由 车架结构、钢丝绳、滑轮、行轮、导向轮、钢丝绳承托轮、钢丝绳防 脱辊、小车牵引张紧器及断绳保险器等组成) 、滑轮、回转支承、吊 钩和制动器组成。 塔吊工作机构有五种:起升机构、变幅机构、小车牵引机构、回 转机构和大车走行机构 (行走式的塔吊 )。 塔吊电气设备包括了液压泵、液压油缸、控制元件、油管和管接 头、油箱和液压油滤清器等主要元器件。 塔吊安全系统和附着锚固则有限位开关 (限位器 ),超负荷保险器 (超载断电装置 ),缓冲止挡装置,钢丝绳防脱装置 ;风速计,紧急安 全开关,安全保护音响信号。而一般来说,自升式塔吊在修筑楼房的 过程中
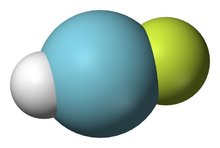
氩气氩化合物
芬兰科学家合成惰性气体元素氩化合物
芬兰赫尔辛基大学的科学家在24日出版的英国《自然》杂志上报告说,他们首次合成了惰性气体元素氩的稳定化合物--氟氩化氢,分子式为HArF。这样,6种惰性气体元素氦、氖、氩、氪、氙和氡中,就只有原子量最小的氦和氖尚未被合成稳定化合物了。惰性气体可广泛应用于工业、医疗、光学应用等领域, 合成惰性气体稳定化合物有助于科学家进一步研究惰性气体的化学性质及其应用技术。
在惰性气体元素的原子中,电子在各个电子层中的排列,刚好达到稳定数目。因此原子不容易失去或得到电子,也就很难与其它物质发生化学反应,因此这些元素被称为"惰性气体元素"。
在原子量较大、电子数较多的惰性气体原子中,最外层的电子离原子核较远,所受的束缚相对较弱。如果遇到吸引电子强的其他原子,这些最外层电子就会失去,从而发生化学反应。1962年,加拿大化学家首次合成了氙和氟的化合物。此后,氡和氪各自的化合物也出现了。
原子越小,电子所受约束越强,元素的"惰性"也越强,因此合成氦、氖和氩的化合物更加困难。赫尔辛基大学的科学家使用一种新技术,使氩与氟化氢在特定条件下发生反应,形成了氟氩化氢。它在低温下是一种固态稳定物质,遇热又会分解成氩和氟化氢。科学家认为,使用这种新技术,也可望分别制取出氦和氖的稳定化合物。
在加拿大工作的英国年轻化学家巴特列特(N.Bartlett)一直从事无机氟化学的研究。自1960年以来,文献上报道了数种新的铂族金属氟化物,它们都是强氧化剂,其中高价铂的氟化物六氟化铂(PtF6)的氧化性甚至比氟还要强。巴特列特首先用PtF6与等摩尔氧气在室温条件下混合反应,得到了一种深红色固体,经X射线衍射分析和其他实验确认此化合物的化学式为O2PtF6,其反应方程式为:
O2+PtF6→O2PtF6
这是人类第一次制得O+2的盐,证明PtF6是能够氧化氧分子的强氧化剂。巴特列特头脑机敏,善于联想类比和推理。他考虑到O2的第一电离能是1175.7千焦/摩尔,氙的第一电离能是1175.5千焦/摩尔,比氧分子的第一电离能还略低,既然O2可以被PtF6氧化,那么氙也应能被PtF6氧化。他同时还计算了晶格能,若生成XePtF6,其晶格能只比O2PtF6小41.84千焦/摩尔。这说明XePtF6一旦生成,也应能稳定存在。于是巴特列特根据以上推论,仿照合成O2PtF6的方法,将PtF6的蒸气与等摩尔的氙混合,在室温下竟然轻而易举地得到了一种橙黄色固体XePtF6:
Xe+PtF6→XePtF6 该化合物在室温下稳定,其蒸气压很低。它不溶于非极性溶剂四氯化碳,这说明它可能是离子型化合物。它在真空中加热可以升华,遇水则迅速水解,并逸出气体:
2XePtF6+6H2O→2Xe↑+O2↑+2PtO2+12HF
芬兰赫尔辛基大学的科学家在24日出版的英国《自然》杂志上报告说,他们首次合成了惰性气体元素氩的稳定化合物--氟氩化氢,分子式为HArF。
这样,6种惰性气体元素氦、氖、氩、氪、氙和氡中,就只有原子量最小的氦和氖尚未被合成稳定化合物了。惰性气体可广泛应用于工业、医疗、光学应用等领域,合成惰性气体稳定化合物有助于科学家进一步研究惰性气体的化学性质及其应用技术。
在惰性气体元素的原子中,电子在各个电子层中的排列,刚好达到稳定数目。因此原子不容易失去或得到电子,也就很难与其它物质发生化学反应,因此这些元素被称为"惰性气体元素"。
在原子量较大、电子数较多的惰性气体原子中,最外层的电子离原子核较远,所受的束缚相对较弱。如果遇到吸引电子强的其他原子,这些最外层电子就会失去,从而发生化学反应。1962年,加拿大化学家首次合成了氙和氟的化合物。此后,氡和氪各自的化合物也出现了。
原子越小,电子所受约束越强,元素的"惰性"也越强,因此合成氦、氖和氩的化合物更加困难。赫尔辛基大学的科学家使用一种新技术,使氩与氟化氢在特定条件下发生反应,形成了氟氩化氢。它在低温下是一种固态稳定物质,遇热又会分解成氩和氟化氢。科学家认为,使用这种新技术,也可望分别制取出氦和氖的稳定化合物。
自19世纪末以来,稀有气体元素不能生成热力学稳定化合物的结论给科学家人为地划定了一个禁区,致使绝大多数化学家不愿再涉猎这一被认为是荒凉贫瘠的不毛之地,关于稀有气体化学性质的研究被忽略了。尽管如此,仍有少数化学家试图合成稀有气体化合物。1932年,前苏联的阿因托波夫(A.R.Antropoff)曾报道,他在液体空气冷却器内,用放电法使氪与氯、溴反应,制得了较氯易挥发的暗红色物质,并认为是氪的卤化物。但当有人采用他的方法重复实验时却未获成功。阿因托波夫就此否定了自己的报道,认为所谓氪的卤化物实际上是氧化氮和卤化氢,并非氪的卤化物。1933年,美国著名化学家鲍林(L.Pauling)通过对离子半径的计算,曾预言可以制得六氟化氙(XeF6)、六氟化氪(KrF6)、氙酸及其盐。扬斯特(D.M.Younst)受阿因托波夫的第一个报道和鲍林预言的启发,用紫外线照射和放电法试图合成氟化氙和氯化氙,均未成功。他在放电法合成氟化氙的实验中将氟和氙按一定比例混合后,在铜电极间施以30000伏的电压,进行火花放电,但未能检验出氟化氙的生成。扬斯特由于对传统观念心有余悸,没有坚持继续进行实验,使一个极有希望的方法半途而废。一系列的失败,致使在以后的30多年中很少有人再涉足这一领域。令人遗憾的是,到了1961年,鲍林也否定了自己原来的预言,认为"氙在化学上是完全不反应的,它无论如何都不能生成通常含有共价键或离子键化合物的能力"。
历史的发展颇具戏剧性,就在鲍林否定其预言的第二年,第一个稀有气体化合物--六氟合铂酸氙(XePtF6)竟奇迹般地出现了,并以它独特的经历和风姿震惊了整个化学界,标志着稀有气体化学的建立,开创了稀有气体化学研究的崭新领域。
在加拿大工作的英国年轻化学家巴特列特(N.Bartlett)一直从事无机氟化学的研究。自1960年以来,文献上报道了数种新的铂族金属氟化物,它们都是强氧化剂,其中高价铂的氟化物六氟化铂(PtF6)的氧化性甚至比氟还要强。巴特列特首先用PtF6与等摩尔氧气在室温条件下混合反应,得到了一种深红色固体,经X射线衍射分析和其他实验确认此化合物的化学式为O2PtF6,其反应方程式为:
O2+PtF6→O2PtF6
这是人类第一次制得O+2的盐,证明PtF6是能够氧化氧分子的强氧化剂。巴特列特头脑机敏,善于联想类比和推理。他考虑到O2的第一电离能是1175.7千焦/摩尔,氙的第一电离能是1175.5千焦/摩尔,比氧分子的第一电离能还略低,既然O2可以被PtF6氧化,那么氙也应能被PtF6氧化。他同时还计算了晶格能,若生成XePtF6,其晶格能只比O2PtF6小41.84千焦/摩尔。这说明XePtF6一旦生成,也应能稳定存在。于是巴特列特根据以上推论,仿照合成O2PtF6的方法,将PtF6的蒸气与等摩尔的氙混合,在室温下竟然轻而易举地得到了一种橙黄色固体XePtF6:
Xe+PtF6→XePtF6
该化合物在室温下稳定,其蒸气压很低。它不溶于非极性溶剂四氯化碳,这说明它可能是离子型化合物。它在真空中加热可以升华,遇水则迅速水解,并逸出气体:
2XePtF6+6H2O→2Xe↑+O2↑+2PtO2+12HF
这样,具有历史意义的第一个含有化学键的"惰性"气体化合物诞生了,从而很好地证明了巴特列特的正确设想。1962年6月,巴特列特在英国Proccedings of the Chemical Society杂志上发表了一篇重要短文,正式向化学界公布了自己的实验报告,一下震动了整个化学界。持续70年之久的关于稀有气体在化学上完全惰性的传统说法,首先从实践上被推翻了。化学家们开始改变了原来的观念,摘掉了冠以稀有气体头上名不副实的"惰性"的帽子,拆除了人为的樊篱,很快形成了一个合成和研究新的稀有气体化合物的热潮,开辟了一个稀有气体化学的新天地。
认识上的障碍一旦拆除,更多的稀有气体化合物很快被陆续合成出来。就在同年8月,柯拉森(H.H.Classen)在加热加压的情况下,以1∶5体积比混合氙与氟时,直接得到了XeF4,年底又制得了XeF2和XeF6。氙的氟化物的直接合成成功,更加激发了化学家合成稀有气体化合物的热情。在此后不长的时间内,人们相继又合成了一系列不同价态的氙氟化合物、氙氟氧化物、氙氧酸盐等,并对其物理化学性质、分子结构和化学键本质进行了广泛的研究和探讨,从而大大丰富和拓宽了稀有气体化学的研究领域。到1963年初,关于氪和氡的一些化合物也陆续被合成出来了。至今,人们已经合成出了数以百计的稀有气体化合物,但却仅限于原子序数较大的氪、氙、氡,至于原子序数较小的氦、氖、氩,目前仍未制得它们的化合物,但有人已从理论上预测了合成这些化合物的可能性。1963年,皮门陶(Pimentaw)等人根据HeF2的电子排布与稳定的HF-2离子相似这一点,提出了利用核反应制备HeF2的3种设想:(1)制取TF-2,再利用氚〔3H(T)〕的β衰变合成HeF2:TF-2→HeF2+β;(2)用热中子辐射LiF,生成HeF2;(3)直接用α粒子轰击固态氟而产生HeF2。但毛姆等人则认为,HeF2和HF-2的电子排布虽然相似,但HF-2可以看成是一个H-跟两个F原子作用成键,H-的电离能仅为22.44千焦/摩尔,而He的电离能却高达 801.5千焦/摩尔,因此是否存在HeF2,在理论上是值得怀疑的,氦能否形成化合物,至今仍是个不解之谜。
化合物的制成
1962年6月,英国青年化学家巴特利特发表了合成Xe(PtF6)的简报,使科学界大为震惊,从此打破了人为划定的不存在"稀有气体元素"化合物的禁区,使"稀有气体元素"化学得到了飞跃的发展。至今,已合成了四百多种"稀有体元素"化合物,其中有的并不需要精密的实验设备,如氙和氟的混和气体只需要放在日光下照射,即可生成二氟化氙。
低温下稳定的氪氮化合物制备成功
1988年,加拿大麦克马斯特大学的施陶贝根宣称,他首次制备并表征了含有氪-氮键的化合物。他用二氟化氪(KrF2)和质子化的氢氰酸盐进行反应,把这两种化合物放入氢氟酸中,并以液氮冷却。然后让反应温度缓慢上升,使这两种化合物溶解,并发生相互作用,在约-60 ℃时生成含有氪-氮键的白色固体化合物。这种氪-氮化合物与其他氙同系物相比是相当不稳定的,它似乎不能在高于-50 ℃的温度下存在
在一定条件下,Xe可与F2发生反应,生成三种稳定的Xe的氟化物。XeF2、XeF4和XeF6:
Xe+nF2→XeF2n(n=1、2、3)
其中XeF4在碱性溶液中迅速分解.
6XeF4+12H2O→2XeO3+4Xe+24HF+3O2
XeF6不完全水解,产物为XeOF4
XeF6+3H2O→XeFO4+6HF
Xe的含氧化物除了XeO3,XeOF4外还有XeF4,HXeO4-和(XeO6)4-等
XeO3+OH- →HXeO4-
2HXeO4-+2OH-→(XeO6)4-+Xe+O2+2H2O
氙金属化合物
三氟化金与氙和原子态氢反应,生成了一种新的黑色晶体,经检测发现这种晶体的成分是新的化合物四氙化金。
氯是卤族元素氙为惰性气体,在正常情况下氯和氙是不会发生反应的,在自然界中也不存在氯和氙的化合物,但在高压和强电场作用下氯可以接受氙的一个电子,形成氯化氙分子,氯化氙不稳定维持的时间很短,很快会解离成为氯和氙,这中不稳定的分子称为准分子,由不稳定的氯化氙准分子受激发而发出的波长为308nm的紫外线激光。
稳定的氙碳化合物首次制成
1989年,联邦德国多特蒙德大学首次制备出一种稳定的氙碳化合物。这种化合物是在乙腈液体中和0 ℃下,使二氟化氙和三(五氯酚氟代苯基)甲硼烷反应生成的。研究人员已用核磁共振装置研究了这种含氙碳键化合物的结构。
氟化氙分三种:二氟化氙,四氟化氙和六氟化氙。他们均为无色晶体,其中二氟化氙熔点为129℃,四氟化氙为113℃,六氟化氙为89℃。XeF2在碱溶液中易被还原成Xe。XeF4则在水中岐化为XeO3+Xe。XeF6则水解成XeO3。氟化氙能被氢气还原为Xe。XeF2能将Cl-变为Cl2,BrO3-变为BrO4-。都可以用氙和氟直接化合生成,也可做氟化剂。
易升华,前二者气态无色,后者黄色。化学活泼性、氧化性和氟化性依次递增。如XeF2 和XeF4 不和SiO2 反应,而XeF6 最终反应生成XeO3 。XeF2 可用作有机物的氟化剂,选择性较好,产率较高。XeF4 及XeF6 和某些有机物接触会引起燃烧或爆炸。改性的XeF6 为有前途的氟化剂。XeF2 可用作氧化铀的氟化剂,以分离铀235。用生成氟化氙除去核反应堆裂变产物放射性氙的小型试验已获成功。用135 XeF4 作核反应堆的减速剂正在试验。控制不同的温度,压力等条件,可由氙和氟直接反应制得上述三种氟化氙。还可通过放电、辐射、光化学反应等制备。
- 相关百科
- 相关知识
- 相关专栏
- 国土资源部办公厅关于开展钻孔基本信息清查工作通知
- 空分设备制氩系统故障分析与操作优化
- 新疆维吾尔自治区水利建设市场主体基本信息登记管理办法
- GBPT生产中酯化通氯化氢工艺技术改造设想
- 23500m^3/h空分设备制氩系统工况分析和调试
- 大厦空调安装工程施工组织方案(氟系统)收集资料
- 富氩混合气体保护焊在压力容器受压焊缝中应用的工艺研究
- 氟制冷活塞压缩并联机组现场安装调试及使用故障处理
- 氟聚合物在丙烯酸酯核壳乳液及耐沾污外墙涂料中应用
- 同安区饮用高氟水降氟改水工程质量检测分析
- 富锂氟花岗岩中存在岩浆成因铁/锂白云母的实验证据
- 氟树脂涂料在江阴大桥混凝土主塔防护涂装上的应用
- 工程勘察工程设计企业基本信息表企业基本情况企业
- 机房气体消防七氟丙烷自动灭火系统设计解决方案
- 单氟磷酸钠对天然碳化高炉矿渣砂浆的影响
- 充氩保护单面焊双面成形在不锈钢高压油管上的应用