氟气简介

氟气简介
氟气,元素氟的气体单质,化学式F₂,淡黄色,腐蚀性非常强,甚至能与极不活泼的金发生反应。氟,化学元素,符号F,化学性质十分活泼,具有很强的氧化性。
氟气造价信息
氟气是一种极具腐蚀性的淡黄色双原子气体。氟是电负度最强的元素,也是很强的氧化剂。在常温下,它几乎能和所有的元素化合,并产生大量的热能,在所有的元素中,要算氟最活泼了。
氟气(F2)是淡黄色的气体,有特殊难闻的臭味,剧毒。在-188℃以下,凝成黄色的液体。在-223℃变成黄色结晶体。在常温下,氟几乎能和所有的元素化合:大多数金属都会被氟腐蚀,碱金属在氟气中会燃烧,甚至连黄金在受热后,也能在氟气中燃烧!许多非金属,如硅、磷、硫等同样也会在氟气中燃烧。如果把氟通入水中,它会把水中的氢夺走,放出氧气(2F₂+2H₂O=4HF+O₂)。例外的只有铂,在常温下不会被氟腐蚀(高温时仍被腐蚀)。
在原子能工业上,氟有着重要的用途:人们用氟从铀矿中提取铀235,因为铀和氟的化合物很易挥发,用分馏法可以把它和其它杂质分开,得到十分纯净的铀235。铀235是制造原子弹的原料。在铀的所有化合物中,只有氟化物具有很好的挥发性能。
氟最重要的化合物是氟化氢。氟化氢很易溶解于水,水溶液叫氢氟酸,这正如氯化氢的水溶液叫氢氯酸(俗名叫盐酸)一样。氢氟酸都是装在聚乙烯塑料瓶里的。如果装在玻璃瓶里的话,过一会儿,整个玻璃瓶都会被它溶解掉——因为它能强烈地腐蚀玻璃(4HF+SiO₂=SiF₄↑+2H₂O)。人们便利用它的这一特性,先在玻璃上涂一层石蜡,再用刀子划破蜡层刻成花纹,涂上氢氟酸。过了一会儿,洗去残余的氢氟酸,刮掉蜡层,玻璃上便出现美丽的花纹。玻璃杯上的刻花、玻璃仪器上的刻度,都是用氢氟酸“刻”成的。由于氢氟酸会强烈腐蚀玻璃,所以在制造氢氟酸时不能使用玻璃的设备,而必须在铅制设备中进行。
在工业上,氟化氢大量被用来制造聚四氟乙烯塑料。聚四氟乙烯号称“塑料之王”,具有极好的耐腐蚀性能,即使是浸在王水中,也不会被侵蚀。它又耐250℃以下的高温和-269.3℃以上的低温。在原子能工业、半导体工业、超低温研究和宇宙火箭等尖端科学技术中,有着重要的应用。中国在1965年已试制成功“聚四氟乙烯”。聚四氟乙烯的表面非常光滑,滴水不沾。人们用它来制造自来水笔的笔尖,吸完墨水后,不必再用纸来擦净墨水,因为它表面上一点墨水也不沾。氟化氢也被用来氟化一些有机化合物。著名的冷冻剂“氟利昂”,便是氟与碳、氯的化合物。
氢氟酸的盐类,如氟化锶、氟化钠、氟化亚锡等,对乳酸杆菌有显著的抑制能力,被用来制造防龋牙膏。常见的“氟化锶”牙膏,便含有大约千分之一的氟化锶。
在大自然中,氟的分布很广,约占地壳总重量的万分之二。最重要的氟矿是萤石——氟化钙。萤石很漂亮,有玻璃般的光泽,正方块状,随着所含的杂质不同,有淡黄、浅绿、淡蓝、紫、黑、红等色。中国在古代便已知道萤石了,并用它制作装饰品。现在,萤石大量被用来制造氟化氢和氟。在炼铝工业上,也消耗大量的萤石,因为用电解法制铝时,加入冰晶石(六氟铝酸钠)可降低氧化铝的熔点。天然的冰晶石很少,要用萤石作原料来制造。除了萤石外,磷灰石中也含有3%的氟。土壤中约平均含氟万分之二,海水中含氟约一千万分之一。
在人体中,氟主要集中在骨骼和牙齿。特别是牙齿,含氟达万分之二。牡蛎壳的含氟量约比海水含氟量高二十倍。植物体也含氟,尤其是葱和豆类含氟最多。
在化学元素史上,参加人数最多、危险最大、工作最难的研究课题,莫过于氟元素的发现。氟元素的发现过程中,不少化学家损害了健康,甚至献出了生命,可以说是一段极其悲壮的化学元素史。
1768年马格拉夫研究萤石,发现它与石膏和重晶石不同,判断它不是一种硫酸盐,1771年化学家舍勒用曲颈瓶加热萤石和硫酸的混合物,发现玻璃瓶内壁被腐蚀。
1810年,法国物理学家安培根据氢氟酸的性质的研究指出,其中可能含有一种与氯相似的元素.化学家戴维的研究,也得出同样的结论。
1813年,英国的戴维用电解氟化物的方法制取单质氟,用金和铂做容器,都被腐蚀了。后来改用萤石做容器,腐蚀问题虽解决了,但却得不到氟,而他则因患病而停止了实验。
接着爱尔兰的乔治·诺克斯和托马斯·诺克斯两兄弟先用干燥的氯气处理干燥的氟化汞,然后把一片金箔放在玻璃接收瓶顶部,反应产生了氟而未得到氟.在实验中,两兄弟都严重中毒。
继诺克斯兄弟之后,鲁耶特对氟作了长期的研究,最后因中毒太深而献出了生命,年仅32岁.法国的弗雷迷电解了无水的氟化钙、氟化钾和氟化银,虽然阳极上产生了少量的气体,但始终未能收集到。
英国化学家哥尔也用电解法分解氟化氢,但在实验的时候发生爆炸,显然产生的少量氟与氢发生了反应.他以碳、金、钯、铂做电极,在电解时碳被粉碎,金、钯、铂被腐蚀。
这么多化学家的努力,虽然都没有制得单质氟,但他们的经验和教训都是极为宝贵的,为后来制取单质氟创造了有利条件。莫瓦桑在1886年第一次通过电解制得单质氟。
氟气简介常见问题
-
在化学元素史上,参加人数最多、危险最大、工作最难的研究课题,莫过于氟元素的发现。氟元素的发现过程中,不少化学家损害了健康,甚至献出了生命,可以说是一段极其悲壮的化学元素史。1768年马格拉夫研究萤石,...
-
氟是性气体,能刺激眼、皮肤、呼吸道粘膜。由于它立即与水反应生成,所以在大多数情况下显出与同样的毒性。当氟浓度为5~10ppm时,对眼、鼻、咽喉等粘膜开始有刺激作用,作用时间长时也可引起肺水肿。与皮肤接...
-
氟气是最活泼的非金属单质。1,与氢气在冷暗处就能剧烈反应而发生爆炸:H2+F2=2HF2,与水相遇,能够夺取水分子中的氧,生成HF并放出氧气:2F2+2H2O=4HF+O2↑3,能置换熔融氯化钠中的氯...
工业制法:电解氟氢化钾与氟化氢的混合物,以压实的石墨做阳极,钢制电解槽槽身做阴极,在373K左右电解。
电解总反应式:2KHF₂==2KF+H₂+F₂常加入氟化锂或氟化铝来降低电解质熔融温度及减轻碳电极的极化作用,不断补充HF。
化学制法;用六氟合锰酸钾与五氟化锑共热得到:K₂MnF₆+SbF₅==K₂SbF7+MnF₄
2MnF4==2MnF₃+F₂
包括:
制造氢氟酸(HF)
制造塑胶
氟化钠(NaF),是一种杀虫剂
饮用水和牙膏里面有氟化物,帮助防止蛀牙
颜色:黄色
标准状况下状态:气态
有毒
密度(标准状况下):1.554kg/m3 比空气大
熔点(标准状况下):-219.62℃
沸点(标准状况下):-188.1℃
氟气是已知的最强的氧化剂。除具有最高价态的金属氟化物和少数纯的全氟有机化合物外,几乎所有有机物和无机物均可以与氟反应。即使是全氟有机化合物,如果被可燃物污染,也可以在氟气中燃烧。
氢与氟的化合异常剧烈,反应生成氟化氢。一般情况下,氧与氟不反应。尽管如此,还是存在两种已知的氧氟化物,即OF2(高于室温时稳定)和O2F2(极不稳定)。由卤素自身形成的化合物有ClF、ClF3、BrF3、IF5,IF7。如上所述,碳或大多数烃与过量氟的反应,将生成四氟化碳及少量四氟乙烯或六氟丙烷。通常,氮对氟而言是惰性的,可用作气相反应的稀释气。氟还可以从许多含卤素的化合物中取代其它卤素。大多数有机化合物与氟的反应将会发生爆炸。
英文名
Fluorine.
用途
火箭燃料中的氧化剂,分离铀同位素,金属的焊接和切割,电镀,玻璃加工,卤化氟的原料,氟化物、含氟塑料、氟橡胶等的制造,药物,农药,杀鼠剂,冷冻剂,等离子蚀刻。
制法
(1)电解溶融KF与2HF混合物。
(2)从含氟矿石中制得。
理化性质
相对分子质量:37.9968
熔点(101.325kPa):-219.62℃
沸点(101.325kPa):-188.1℃
液体密度(-188.1℃,S.P.):1507kg/m3
气体密度(25℃,101.325kPa):1.554kg/m3
相对密度(气体,空气=1,25℃,101.325kPa):1.312
比容(21.1℃,101.325kPa):0.6367m3/kg
临界温度:-128.8℃
临界压力:5215kPa
临界密度:574 kg/m3
熔化热(-219.67℃,0.252kPa):13.44 KJ/kg
气化热(-188.2℃,101.325kPa):175.51 KJ/Kg
比热容(气体,21.1℃,101.325kPa):
Cp=827.67J/(Kg?K)
Cv=609.65J/(Kg?K)
比热比(气体,21.1℃,101.325kPa):Cp/Cv=1.358
蒸气压(53.56K):0.223kPa
(77.17K):37.383kPa
(89.40K):162.638kPa
粘度(气体,0℃,101.325kPa):0.02180mPa?s
(液体,-192.2℃):0.275mPa?S
表面张力(-193.2℃):14.81mN/m
导热系数(气体,0℃,101.325kPa):0.024769W/(m?K)
(液体,-188.1℃):0.159W/(m?K)
折射率(气体,25℃,101.325kPa):1.000187
(液体,-188.1℃):1.2
电负性:4.0(泡林标度)3.98(新泡林标度)
毒性级别:4
易燃性级别:0
易爆性级别:3
火灾危险度:极大
氟在常温常压下为具有刺激性臭的淡黄色有毒气体。氟是在非金属元素中最活泼的,氧化性极强,在自然界中没有游离态的氟。它是助燃性气体。在室温下能与大多数可氧化物质或有机物强烈反应而燃烧。它和甲烷在一起时能发生爆炸,与硝酸反应生成具有爆炸性的气体硝酸氟。氟遇水反应产生氟化氢、氟化氧、臭氧、过氧化氢、氧等。容易引起燃烧。可与液态氧或氮混合。
氟与一些物质混合接触时的危险性如下表。
混合接触部分物质的危险
混合接触危险物质名称 化学式 危险等极 摘要
氯酸钠 NaClO₃ B
高氯酸钠 NaClO₄ B
过氧化氢 H₂O₂ B
过氧化钠 Na₂O₂ A
硝酸铵 NH₄NO₃ B
硝酸钠 NaNO₃ B
高锰酸钾 KMnO₄ A
铜 Cu A 在常温下有着火的危险性
铅 Pb A 有猛烈着火的危险性
硫 S A 在常温下有着火的危险性
镁 Mg A 根据条件有着火的可能性
锌 Zn A 有发生反应而着火的危险性
锰 Mn A 根据条件可能起火
硅 Si A 在常温下有着火的危险性
钾 K A 在常温下有着火的危险性
钠 Na A 在常温下有着火的危险性
氧化钙 CaO A 有发生激列放热反应的危险性
乙醛 CH₃CHO A 有激烈反应的危险性
二硫化碳CS₂ A 在常温下有起火的危险性
二甲胺(CH₃)2NH A 有着火的危险性
正丁醇 C₄H9OH A
甲醇 CH₃OH A
吡啶 C₅H₅N A 有着火的危险性
二甲胺基甲醛(CH₃)₂NCHO A
硝酸 HNO₃C
硫酸 H₂SO₄A
三氧化铬 CrO₃A
亚氯酸钠 NaClO₂B
溴酸钠 NaBrO₃B
重铬酸钾 K₂Cr₂O7 A
锂 Li A 根据条件可能着火
钙 Ca A 有猛烈起火的可能性
二硅化钙 CaSi₂A 有着火的危险性
蒽 C14H10 A 根据条件可能起火、爆炸
三氯甲烷 CHCl₃A 有激烈爆炸反应的危险性
四氯化碳 CCl₄B 有激烈爆炸反应的危险性
铷 Rb A 根据条件可能起火
铯 Cs A 根据条件可能起火
叠氮化氢 HN₃A 有爆炸的危险性
砷 As A 在常温下有激烈反应的危险性
乙酸钠 CH₃COONa A 有爆炸的危险性
氯化氢 HCl A 低温有激烈反应的危险性
五氯化磷 PCl₅有发生炽热反应、起火的危险性
三氯化磷 PCl₃ 有发生炽热反应、起火的危险性
氟化氢 HF 根据条件可能爆炸
碘化氢 HI B 低温有激烈反应的危险性
碘 I₂ A 常温下有起火的危险性
钼 Mo A 根据条件可能起火
铀 U A 根据条件可能起火
硅酸钠 Na₂SiO₃有着火的危险性
溴 Br₂ B
三硫化二锑 Sb₂S₃A 在常温下反应.有起火的危险性
氨 NH₃ A
氯 Cl₂B 有起火、爆炸的危险性
一氧化氮 NO B 有立即反应而起火的危险性
三氟化磷 PF₃有起火的危险性
四氧化二氮 N₂O₄C 有起火的危险性
氢气 H₂A 有激烈爆炸的危险性
一氧化碳 CO A 有爆炸反应的危险性
乙炔 CH≡CH A 有激烈反应的危险性
溴化氢 HBr B 低温下有激烈反应的危险性
三氧化硫 SO₂ A 根据条件可能爆炸
硫化氢 H₂S A 在常温下有起火的危险性
苯胺 C₆H₅NH₂有着火的危险性
毒性
人吸入TCLo:25ppm?5分钟,对眼有刺激性。
最高容许浓度:0.1ppm(0.2mg/m3)
氟是剧毒性气体,能刺激眼、皮肤、呼吸道粘膜。由于它立即与水反应生成氟化氢,所以在大多数情况下显出与氟化氢同样的毒性。
当氟浓度为5~10ppm时,对眼、鼻、咽喉等粘膜开始有刺激作用,作用时间长时也可引起肺水肿。与皮肤接触可引起毛发的燃烧,接触部位凝固性坏死、上皮组织碳化等。慢性接触可引起骨硬化症和韧带钙化。吸入氟的患者应立即转移至无污染的安全地方安置休息,并保持温暖舒适。眼睛或皮肤受刺激时迅速用水冲洗之后就医诊治。
安全防护
工作场所要通风保持空气新鲜干燥。要用特种钢瓶贮装。钢瓶存放时必须与其它物料隔离,特别是与能和氟反应的物料隔绝,要远离易起火地点。
着火时消防人员须在防爆掩蔽处操作,切不可将水直接喷射漏气处,否则会助长火势。灭火可用二氧化碳、干粉、砂土、废气可用水吸收。
安全与运输
氟气是一种毒性极高的强腐蚀性气体,在湿空气中易形成氟化氢。氟的腐蚀性突出表现为强烈的酸性刺激性,其性质同氟化氢相似。与水、水蒸气反应,产生有毒腐蚀性烟气,并放出热。
氟气对皮肤的灼伤速度比氢氟酸快许多,眼睛是氟中毒的敏感部位,它对眼睛的刺激程度也大大超过氢氟酸。呼吸到低含量的氟气不会产生明显的生理病变,但经过呼吸系统进入人体的骨组织内,引起化学反应导致骨质松软。氟气属有毒压缩气体,宜储存于阴凉、通风仓内,仓内温度不宜超过"%A,并应远离火种、热源。氟气应与易燃或可燃物、金属粉末等分开存放。
氟气简介文献

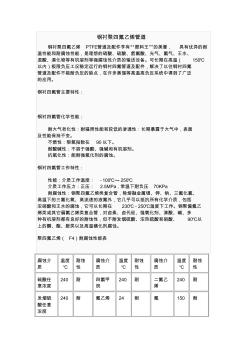 钢衬四氟简介
钢衬四氟简介
钢衬聚四氟乙烯管道 钢衬聚四氟乙烯 PTFE管道及配件亨有“塑料王”的美誉, 具有优异的耐 温性能和耐腐蚀性能,是理想的硝酸、硫酸、氢氟酸、光气、氯气、王水、 混酸、溴化物等有机溶剂等强腐蚀性介质的输送设备。可长期在高温( 150℃ 以内)极限负压工况稳定运行的钢衬四氟管道及配件,解决了以往钢衬四氟 管道及配件不能耐负压的缺点,在许多蒸馏等高温高负压系统中得到了广泛 的应用。 钢衬四氟管主要特性: 钢衬四氟管化学性能: 耐大气老化性:耐辐照性能和较低的渗透性:长期暴露于大气中,表面 及性能保持不变。 不燃性:限氧指数在 90以下。 耐酸碱性:不溶于强酸、强碱和有机溶剂。 抗氧化性:能耐强氧化剂的腐蚀。 钢衬四氟管工作特性: 性能:介质工作温度: - 100℃~- 250℃ 介质工作压力:正压: 2.5MPa,常温下耐负压 70KPa 耐腐蚀性:钢聚四氟乙烯类复合管,除熔融金属锂、钾、

 1衬氟阀门简介
1衬氟阀门简介
1衬氟阀门简介 聚四氟乙烯俗称“”, 是由美国 DUPONT CO.,LTD于 1938年首先 研制问世,1949 年进行工业化生产,从工业应用角度已有 50年的历史,而真正将其广泛应用在 阀门行业中的时间并不长。 衬氟阀门是对阀体内介质所能达到的地方全部采用衬里工艺, 内衬材料一般采用 FEP(F46)和 PCTFE(F3)等氟塑料,可以适用于各种浓度的硫酸、盐酸、、和各种 有机酸、强酸、及其它腐蚀性介质等管路,但衬氟阀门受温度的局限比较大 (只 适用于摄氏 - 50℃~150℃之间的介质 ),能够制作内衬氟塑料的阀门有: 、、、、、 衬氟等。 2衬氟阀门主要衬里材料 聚 FEP (F46) 适用介质: 任何有机溶剂或试剂,稀或浓无 机 酸,碱,酮,芳烃,氯化烃等。 使用温度: -85~150 特点:力学,电性能和基本与 F4相同,但突出优点是动击韧性 高,有极好的和辐射性。 聚三
衬氟气动球阀内腔及球体均采用高压注塑工艺衬有耐腐蚀、耐老化的聚全氟乙丙稀(F46),故具有可靠的耐腐蚀性和密封性。广泛用于化工、石油、冶金、医药等工业部门,实现对生产过程中酸、碱等强腐蚀介质的调节或切断,在水处理过程控制中使用效果最明显。
氟气气体报警器广泛应用于燃气、石油、化工、冶炼、生化、制药、机械、加油站、加气站、冷库、食品厂、厨房、锅炉房、钢铁厂、电子、喷涂、油棉厂、生物、沼气池、下水道等存在氟气气体的危险场所。
1、检测气体:氟气
2、传 感 器:电化学式
3、检测范围:0-1PPM/0-5PPM/0-10PPM/0-20PPM
4、分 辨 率:1PPM/0.1PPM/0.01PPM
5、报 警 点:设置低、高报两级报警点
6、检测方式:自然扩散式
7、检测精度:±3%F.S
8、接线方式:总线式:RVV4*1.0mm2(无信号干扰下);RVVP4*1.0mm2(有信号干扰的情况下)
分线式:RVV3*1.0mm2(无信号干扰下);RVVP3*1.0mm2(有信号干扰的情况下)
9、接线方式:总线式:四线制;分线式:三线制
10、防爆等级:Exd II CT6
11、防护等级:IP65
12、相应时间:≤30s
13、输出信号:分线式4-20mA模拟信号输出,总线式RS485输出
14、温度范围:-40℃-70℃
15、湿度范围:≤95%
16、防爆方式:隔爆型
17、工作电压:控制器:AC220V±10%;探测器:DC24V±25%
18、探测器与控制器最大距离:≤1000m
19、安装螺纹:G1/2″内螺纹
20、安装方式:壁挂式、支架式、管装
- 相关百科
- 相关知识
- 相关专栏
- 永磁同步电机简介
- 以色列ELI自清洗网式过滤器和浅层介质过滤器简介
- 有关水利水电勘测设计技术标准体系情况的简介
- 工程技术分析论文地辐射采暖系统简介及常见问题
- 工程定额及造价资料电子查阅与简易预结算编制系统简介
- 广(州)深(圳)准高速铁路石龙—常坪段路基施工简介
- 基于GIS技术安徽省主要防洪工程信息系统简介
- 广东省东江—深圳供水改造工程施工图设计监理工作简介
- 乐星产电乐星产电(无锡)有限公司二期工程项目简介
- 国家玻璃质量监督检验中心安全玻璃CCC认证业务简介
- 建筑工程门窗系列产品节点图及简介PPT
- 混凝土搅拌车底盘简介
- 模具钢材料简介
- 205国道衢州段开展公路养护工程标准化工地建设活动简介
- 公路工程造价的计价与控制计价规范简介模拟试题
- 中国安全生产科学研究院注册安全工程师注册管理中心简介