臭氧基本信息
| 中文名称 | 臭氧 | 英文名 | ozone |
|---|---|---|---|
| 化学式 | O₃ | 熔点 | -192℃ |
| 沸点 | -111℃ | 水溶性 | 1体积水溶解0.494体积臭氧 |
| 密度 | 2.14g/L(0°C,0.1MP) | 外观 | 常温下蓝色气体 |
| 应用 | 用于医学、农业、餐饮业、杀菌等EINECS登录号 | ||

臭氧安全浓度
根据清华大学编的《臭氧技术应用文集》一书,将有关臭氧应用浓度按安全浓度空气、应用浓度、水中应用浓度、环境浓度及感知浓度,分类摘录,以便在应用中查找。 安全浓度人们允许接触的臭氧浓度不大于0.2mg/m3。
◎臭氧工业卫生标准: 国际臭氧协会: 0.1 ppm,接触10小时 美 国: 0.1 ppm,接触 8小时 德、法、日 本: 0.1 ppm中 国: 0.15ppm
◎家用臭氧消毒柜外臭氧泄漏量不得超过0.2mg/m3(指1.5米以外),消毒一个周期后残留浓度不得大于0.2mg/m?。
◎动物试验表明,臭氧毒性的起点浓度为0.3ppm,而人对空气中臭氧可嗅知的浓度为0.02~0.04ppm,根据臭氧对肺功能毒性的试验结果,提出1.5~2.0ppm为臭氧允许浓度的上限。卫生部规定臭氧最高允许浓度为0.2mg/m?。
空气应用浓度
◎作为空气除味与杀菌,要求臭氧浓度较低,如0.5ppm(1mg/m?),而物品表面消毒(杀灭微生物和去除化学污染)则要求提高几十倍的臭氧浓度。
◎空气应用具氧浓度在1mg/m?~10mg/m?之间。
◎温度低,湿度大则杀灭效果好,尤其是湿度,相对湿度小于45%,臭氧对空气中悬浮微生物几乎没有杀灭作用。在60%时才逐渐增强,在95%时达到最大值。
◎用臭氧消毒食品加工车间,0.5~1.0ppm即可杀灭空气中的80%的自然菌。
◎冷库消毒要求臭氧浓度6~10ppm,停机后封库24小时以上细菌杀灭率90%左右,霉菌杀灭率80%左右。
◎在水果贮藏期间,可用2~3ppm的臭氧可使霉菌的生长受到抑制,贮藏期可延长一倍。
水中应用浓度
◎水应用中臭氧溶解度在0.1mg/L~10mg/L之间。低值作为水消毒净化要求的最低浓度,高值作为“臭氧水消毒剂” 可达到的浓度值。
◎自来水臭氧净化,国际常规标准为0.4mg/L的溶解度值,保持4分钟,即CT值为1.6。
◎水中余臭氧浓度保持在0.1~0.5mg/L作用5~10min可达消毒目的。
◎臭氧水消毒灭菌是急速的,消毒作用在瞬间发生。清水中臭氧浓度一旦达到,在0.5~1分钟内就杀死细菌,在浓度达4mg/L,在1分钟内乙肝病毒灭活率为100%。
◎Herbold报道:20℃条件下,水中臭氧浓度达0.43mg/L时,可将大肠杆菌100%杀灭,10℃时仅需0.36mg/L即可全部杀灭。
◎臭氧浓度为0.25~38mg/L时,仅需几秒或几分钟完全灭活甲型肝炎病毒(HAV)。
◎矿泉水中臭氧溶解度在0.4~0.5mg/L时,即可满足杀菌保质要求。合理的臭氧投放量为1.5~2.0mg/L。
◎瓶装水处理应达0.3~0.5mg/L的臭氧溶解度值,要求投加臭氧应满足 1m?水2gO?的发生量。根据实践经验,臭氧发生浓度高于8mg/L时容易达到浓度。
臭氧造价信息
1 、食物净化: 由表及里的降解果蔬、粮食中残留的化肥、农药等有毒物质,清除肉、蛋中的抗生素、化学添加剂、激素等有害物质,杀灭海鲜中容易引起中毒的嗜盐性菌,把住病从口入关。
2 、饮用水净化: 自来水经臭氧处理后是一种优质的生饮水。每升水只需通入 O3 2 分钟即可去除水中的余氯,杀菌、消毒、去味、去除重金属,防止致癌物质三氯甲烷的生成,增加水中含氧量,自制理想纯净的饮用水。
3 、消毒灭菌: 将清洗后的餐饮用具放入水中通入 O3 20 分钟,可去除洗涤剂残留物,杀灭细菌、病毒,替代电子消毒柜,避免餐饮用具传染疾病。还可对衣物、毛巾、抹布、袜子等进行水介质消毒、除味。
4 、空气净化: 将臭氧排气管挂在 1.7 米以上高度,排放 O3 20--30 分钟,即可有效去除室内烟尘或装饰材料的异味,降尘灭菌,增加空气含氧量,清新空气,让您在家中享受到雨后森林般清新的空气(可用于家庭、办公室、会议室、娱乐场所的除烟、除尘、消毒、去味)。
5 、果蔬保鲜、防霉: 家庭果蔬保鲜只需往袋装果蔬中通入 O3 2 分钟,可延长保鲜期 7 天,也可用于菜窖防霉、果蔬运输。
6 、洗浴、美容、保健: 洗臭氧浴在国外已成为时尚,通过臭氧浴治疗疾病已有多年历史,这是 O3 的又一神奇功效。经常洗臭氧浴能排除体内毒素,活化表皮细胞,消除痤疮,美白皮肤,对风湿病、皮肤病、妇科病、糖尿病及灰指甲等有良好疗效。
7 、养鱼、浇花: 浇花、大棚蔬菜的喷灌,能避免虫害,减少农药使用量。 养鱼、水产养殖, O3进入水中释放出初生态氧,消灭细菌、病毒,氧化杂质,防止水质腐坏变质,增加水中养份。
8 、除臭: 因臭氧有很强的氧化分解能力,可迅速而彻底的消除空气中、水中的各种异味。

臭氧发现过程
英文臭氧(Ozone)一词源自希腊语ozon,意为“嗅”。
西班牙文名称为Ozono臭氧具有等腰三角形结构,三个氧原子分别位于三角形的三个顶点,顶角为116.79度。
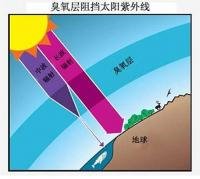
1840年德国C.F.舍拜恩在电解稀硫酸时 ,发现有一种特殊臭味的气体释出 ,因此将它命名为臭氧 。当大气层中的氧气发生光化学作用时,便产生了臭氧,因此,在离地面垂直高度15~25千米处形成臭氧层,它的浓度为0.2ppm。臭氧的气体明显地呈蓝色,液态呈暗蓝色,固态呈蓝黑色。它的分子结构呈三角形 。臭氧不稳定,在常温下慢慢分解 ,200℃时迅速分解 ,它比氧的氧化性更强,能将金属银氧化为过氧化银 ,将硫化铅氧化为硫酸铅,它还能氧化有机化合物,如靛蓝遇臭氧会脱色 。臭氧在水中的溶解度较氧大,0℃,一标准大气压时,一体积水可溶解0.494体积臭氧。臭氧能刺激粘液膜 ,它对人体有毒 ,长时间在含0.1ppm臭氧的空气中呼吸是不安全的。臭氧层能吸收大部分波长短的射线(如紫外线 ),起着保护人类和其他生物的作用,但氯气和氟化物促使臭氧分解为氧 ,破坏了臭氧保护层,成为人类关注的重要环境问题之一。通常都借助无声放电作用从氧气或空气制备臭氧,臭氧发生器即根据这一原理制造。利用臭氧和氧气沸点的差别,通过分级液化可得浓集的臭氧。臭氧是强力漂白剂,用于漂白面粉和纸浆,用臭氧消毒饮用水,水中只含氧,无特殊气味。它还用于污水处理。
臭氧极易分解,很不稳定。它不溶于液态氧,四氯化碳等。有很强的氧化性,在常温下可将银氧化成 氧化银,将硫化铅氧化成硫酸铅。臭氧可使许多有机色素脱色,侵蚀橡胶,很容易氧化有机不饱和化合物。臭氧在冰中极为稳定,其半衰期为2000年。
1785年,德国人在使用电极时,发现在电极放电时产生一种异味。1840年法国科学家克里斯蒂安·弗雷德日将它确定为臭氧。
在紫外线辐射下,通过电子放射或暴晒从双原子氧气可自然形成臭氧。工业上,用干燥的空气或氧气,采用5~25kv的交流电压进行无声放电制取。另外,在低温下电解稀硫酸,或将液体氧气加热都可制得臭氧。
臭氧可用于净化空气,漂白饮用水,杀菌,处理工业废物和作为漂白剂。
在夏季,由于工业和汽车废气的影响,尤其在大城市周围农林地区在地表臭氧会形成和聚集。地表臭氧对人体,尤其是对眼睛,呼吸道等有侵蚀和损害作用。地表臭氧也对农作物或森林有害。
臭氧常见问题
-
一般来说,大气中的臭氧大部分集中在10公里至50公里之间的大气层中,其中20公里至30公里之间臭氧含量最高,人们通常把大气中臭氧集中的层次叫臭氧层。臭氧层由法国科学家于20世纪初发现的。 臭氧是在18...
-
臭氧发生器的臭氧浓度、产量、电耗的测量和计算方法 :方法原理概要:1、臭氧(O3)是一种强氧化剂,与碘化钾(KI)水溶液反应可游离出碘;2、在取样结束并对溶液酸化后,用0.1000mol/L...
-
什么是臭氧 人类发现臭氧已经有一百年的历史。在距离地球表面15-25公里的高空,因受太阳紫外线照射的缘故,形成了包围在地球外围空间的臭氧层,这厚厚的臭氧层正是人类赖以生存的保护伞。这就是大多数人...
臭氧理化性质
物理性质
在常温常态常压下,较低浓度的臭氧是无色气体,当浓度达到 15%时,呈现出淡蓝色。臭氧可溶于水,在常温常态常压下臭氧在水中的溶解度比氧高约13倍,比空气高25倍。但臭氧水溶液的稳定性受水中所含杂质的影响较大,特别是有金属离子存在时,臭氧可迅速分解为氧,在纯水中分解较慢。臭氧的密度是2.14g/L(0°C,0.1MP),沸点是-111°C,熔点是-192°C。臭氧分子结构是不稳定的,它在水中比在空气中更容易自行分解。臭氧的主要物理性质列于表1-1,臭氧在不同温度下的水中溶解度列于表1-2。臭氧虽然在水中的溶解度比氧大10倍,但是在实际上它的溶解度甚小,因为他遵守亨利定律,其溶解度与体系中的分压和总压成比例。臭氧在空气中的含量极低,故分压也极低,那就会迫使水中臭氧从水和空气的界面上逸出,使水中臭氧浓度总是处于不断降低状态。
| 性质 | 数据 |
| 分子量 | 47.99828 |
| 沸点 | -111.9℃ |
| 熔点 | -193℃ |
| 临界温度 | -5℃ |
| 临界压力 | 92.3atm |
| 等张比容 | 75.7(90.2K) |
| 生成热 | -144KJ/mol |
| 在水中的溶解度ml/100ml | 49.4 |
化学性质
1. 臭氧很不稳定,在常温常态常压下即可分解为氧气。臭氧、氯和二氧化氢的氧化势(还原电位)分别是2.07.1.36.1.28伏特,可见臭氧在处理水中是氧化力量最强的一种。臭氧的氧化作用导致不饱和的有机分子的破裂。使臭氧分子结合在有机分子的双键上,生成臭氧化物。臭氧化物的自发性分裂产生一个羧基化合物和带有酸性和碱性基的两性离子,后者是不稳定的,可分解成酸和醛。其反应式为:
2O₃→3O₂+ 285kJ ( 1-2 )
由于分解时放出大量热量,故当其含量在 25 %以上时,很容易爆炸。但一般臭氧在空气中,臭氧的含量很难超过 10 %以上,在臭氧用于饮用水处理的较长过程中,还没有一例氧爆炸的事例。
含量为 1 %以下的臭氧,在常温常态常压的空气中分解半衰期为 16h 左右。随着温度的升高,分解速度加快,温度超过 100℃ 时,分解非常剧烈,达到 270℃ 高温时,可立即转化为氧气。臭氧在水中的分解速度比空气中快。在含有杂质的水溶液中臭氧迅速回复到形成它的氧气。如水中臭氧浓度为 6.25×10 -5 mol/L(3mg/l) 时,其半衰期为 5 ~ 30min ,但在纯水中分解速度较慢,如在蒸馏水或自来水中的半衰期大约是 20min ( 20℃ ),然而在二次蒸馏水中,经过 85min 后臭氧分解只有 10 %,若水温接近 0℃ 时,臭氧会变得更加稳定。
2. 臭氧的氧化能力
臭氧得氧化能力极强,其氧化还原电位仅次于 F? ,在其应用中主要用这一特性。
3. 臭氧的氧化反应
a 、与无机物的氧化反应
臭氧与亚铁、Mn2+ 、硫化物、硫氰化物、氰化物、氯等均发生反应
如:
O?+SO₂==SO?+O₂
O?+CO?==CO?+O2
O?+NO?==NO?+O?
3O?+4NH?==NH?NO?+2NH4O?
4O?+PbS==PbSO?+4O?
Ag+O?==Ag?O+O?
XeO?+4OH?+O?==XeO6+O?+2H?O
3CN-+O?==3OCN?
2OCN?+O?==CO?2?+O?+N?
b 、臭氧与有机物的反应
臭氧在水溶液中与有机物的反应极其复杂,
⑴ 臭氧与烯烃类化合物的反应 臭氧容易与具有双链的烯烃化合物发生反应,反应的最终产物可能是单体的、聚合的、或交错的臭氧化物的混合体。臭氧化物分解成醛和酸。
⑵ 臭氧和芳香族化合物的反应 臭氧和芳香族化合物的反应较慢,在系列苯<萘<菲<嵌二萘<蒽中,其反应速度常数逐渐增大。
⑶ 对核蛋白(氨基酸)系、有机氨也都发生反应
臭氧在下列混合物的氧化顺序为
链烯烃>胺>酚>多环芳香烃>醇>醛>链烷烃
c 、臭氧的毒性和腐蚀性
臭氧属于有害气体,浓度为 6.25×10mol/L(0.3mg/m? ) 时,对眼、鼻、喉有刺激的感觉;浓度 (6.25-62.5)×10 -5 mol/L(3 ~ 30mg/m? ) 时,出现头疼及呼吸器官局部麻痹等症 ; 臭氧浓度为 3.125×10 -4 ~ 1.25×10 -3 mol/L(15 ~ 60mg/m? ) 时 , 则对人体有危害。其毒性还和接触时间有关,例如长期接触 1.748×10 -7 mol/L(4ppm) 以下的臭氧会引起永久性心脏障碍,但接触 20ppm 以下的臭氧不超过 2h ,对人体无永久性危害。因此,臭氧浓度的允许值定为 4.46×10 -9 mol/L(0.1ppm)8h. 由于臭氧的臭味很浓,浓度为 4.46×10 -9 mol/L(0.1ppm) 时,人们就感觉到,因此,世界上使用臭氧已有一百多年的历史,至今也没有发现一例因臭氧中毒而导致死亡的报道。
臭氧具有很强的氧化性,除了金和铂外,臭氧化空气几乎对所有的金属都有腐蚀作用。铝、锌、铅与臭氧接触会被强烈氧化,但含铬铁合金基本上不受臭氧腐蚀。基于这一点,生产上常使用含 25 % Cr 的铬铁合金(不锈钢)来制造臭氧发生设备和加注设备中与臭氧直接接触的部件。
臭氧对非金属材料也有了强烈的腐蚀作用,即使在别处使用得相当稳定得聚氯乙烯塑料滤板等,在臭氧加注设备中使用不久便见疏松、开裂和穿孔。在臭氧发生设备和计量设备中,不能用普通橡胶作密封材料,必须采用耐腐蚀能力强的硅橡胶或耐酸橡胶等。
化学性质及功效
臭氧(O3)是氧气(O2)的同素异形体,它是一种具有特殊气味的淡蓝色气体。分子结构呈三角形,键角为116°,其密度是氧气的1.5倍,在水中的溶解度是氧气的10倍。臭氧是一种强氧化剂,它在水中的氧化还原电位为2.07V,仅次于氟(2.5V),其氧化能力高于氯(1.36V)和二氧化氯(1.5V),能破坏分解细菌的细胞壁,很快地扩散透进细胞内,氧化分解细菌内部氧化葡萄糖所必须的葡萄糖氧化酶等,也可以直接与细菌、病毒发生作用,破坏细胞、核糖核酸(RNA),分解脱氧核糖核酸(DNA)、RNA、蛋白质、脂质类和多糖等大分子聚合物,使细菌的代谢和繁殖过程遭到破坏。细菌被臭氧杀死是由细胞膜的断裂所致,这一过程被称为细胞消散,是由于细胞质在水中被粉碎引起的,在消散的条件下细胞不可能再生。应当指出,与次氯酸类消毒剂不同,臭氧的杀菌能力不受PH值变化和氨的影响,其杀菌能力比氯大600-3000倍,它的灭菌、消毒作用几乎是瞬时发生的,在水中臭氧浓度0.3-2mg/L时,0.5-1min内就可以致死细菌。达到相同灭菌效果(如使大肠杆菌杀灭率达99%)所需臭氧水药剂量仅是氯的0.0048%。
臭氧对酵母和寄生生物等也有活性,例如可以用它去除以下类型的微生物和病毒。
①病毒 已经证明臭氧对病毒具有非常强的杀灭性,例如Poloi病毒在臭氧浓度为0.05-0.45mg/L时,2min就会失去活性。
②孢囊 在臭氧浓度为0.3mg/L下作用2.4min就被完全除掉。
③孢子 由于孢衣的保护,它比生长态菌的抗臭氧能力高出10-15倍。
④真菌 白色念珠菌(candida albicans)和青霉属菌(penicillium)能被杀灭。
⑤寄生生物 曼森氏血吸虫(schistosoma mansoni)在3min后被杀灭。
此外,臭氧还可以氧化、分解水中的污染物,在水处理中对除嗅味、脱色、杀菌、去除酚、氰、铁、锰和降低COD、BOD等都具有显著的效果。
应当注意,虽然臭氧是强氧化剂,但其氧化能力是有选择性的,像乙醇这种易被氧化的物质却不容易和臭氧作用。
臭氧对人类的危害
低浓度的臭氧可消毒。一般森林地区臭氧浓度即可达到0.1ppm 但超标的臭氧则是个无形杀手!
▲ 它强烈刺激人的呼吸道,造成咽喉肿痛、胸闷咳嗽、引发支气管炎和肺气肿;
▲ 臭氧会造成人的神经中毒,头晕头痛、视力下降、记忆力衰退;
▲ 臭氧会对人体皮肤中的维生素E起到破坏作用,致使人的皮肤起皱、 出现黑斑;
▲ 臭氧还会破坏人体的免疫机能,诱发淋巴细胞染色体病变,加速衰老, 致使孕妇生畸形儿;
▲ 而复印机墨粉发热产生的臭氧及有机废气更是一种强致癌物质,它会引发各类癌症和心血管疾病。
臭氧作为气体消毒剂,其杀菌过程为强氧化作用使微生物细胞中的多种成分产生反应,从而产生不可逆转的变化而死亡。一般认为,臭氧灭活病毒是通过直接破坏其核糖核酸或脱氧核糖核酸完成的。而杀灭细菌、霉菌类微生物则是臭氧首先作用于细胞膜,使膜构成成分受损失,导致新陈代谢障碍并抑制其生长,臭氧继续渗透破坏膜内组织,使其死亡。湿度增加可提高杀灭率,是由于在湿度下细胞膜膨胀变薄,其组织容易被臭氧破坏。 臭氧去除异味性能极好。它的强氧化性能使各种有臭味的无机或有机物质氧化,除掉其臭味。臭味的主要成分是胺类物质、硫化氢、甲硫醇、二甲硫化合物、二甲二硫化物等。它们与臭氧作用几分钟即可被臭氧氧化,除去臭味。
臭氧在废水中可用来脱色。有色物质中的发色基团有: 乙烯基、偶氮基、氧化偶氮基、羧基、硫羧基、硝基、亚硝基等。臭氧能打开它们的不饱键,使之失去显色能力。
臭氧氧化水中的酚属于自由基反应,首先经过链的引发,进而引进羟基,直至最后氧化为二氧化碳和水。臭氧还能氧化电镀废水中的氰。臭氧对无机金属离子诸如Fe2+、Mn2+等的氧化均与氯气相似,将其氧化为较高价态的稳定的沉淀物。应用臭氧、活性炭同时处理废水,活性炭能催化臭氧的氧化,并可降低臭氧消耗量。
臭氧文献

 臭氧环境浓度标准
臭氧环境浓度标准
环境空气质量标准 质量分级编辑 环境空气质量功能区分类 环境空气功能区分为二类: 一类区为自然保护区、风景名胜区和其他需要特殊保护的区域; 二类区 为居住区、商业交通居民混合区、文化区、工业区和农村地区。 环境空气质量标准分级 环境空气质量标准分为二级 一类区执行一级标准 二类区执行二级标准 GB编辑 4.2 环境空气功能区质量要求一类区适用一级浓度限值, 二类区适用二级浓度限值。 一、 二类环境空气功能区质量要求见表 14.3 本标准自 2016 年 1 月 1 日起在全国实施。基本 项目(表 1)在全国范围内实施;其他项目(表 2) 即 0.123ppm~0.155ppm 由国务院环境保护行政主管部门或者省级人民政府根据实际情况,确定具体实施方式。 4.4 在全国实施本标准之前, 国务院环境保护行政主管部门可根据 《关于推进大气污染联防 联控工作改善区域空气质量的指导意见》 等文件要

 外置式臭氧发生器,洁净车间用臭氧消毒机,风管式臭氧设备.
外置式臭氧发生器,洁净车间用臭氧消毒机,风管式臭氧设备.
外置式臭氧发生器,洁净车间用臭氧消毒机,风管式臭氧设备.
臭氧浓度表示了臭氧制备设备产生臭氧的能力,是指单位体积内臭氧的重量之和,这个值越大,表示臭氧制备设备产生臭氧的速度越快。由于臭氧很不稳定,会自行分解,因此臭氧需要现制现用。
由于这个浓度值比较抽象,并且不同厂商标注这个参数时使用不同的单位。此外呼吸浓度过高或者长时间呼吸浓度较高的臭氧对人的身体有害,甚至造成中毒,因此臭氧浓度也不是越高越好。
后臭氧(post-ozonation)指的是设置在过滤之前或过滤之后的臭氧净水工艺。
后臭氧(post-ozonation)指的是设置在过滤之前或过滤之后的臭氧净水工艺。
原水水质差异和臭氧化特性使得当前对预臭氧化的利弊说法不一,并且臭氧应用成本较高、国内经验不多,使它的应用,受到了一定限制。 通过预臭氧 常规自来水处理工艺 臭氧 活性炭,可生产出高品质的饮用自来水。2100433B
- 相关百科
- 相关知识
- 相关专栏
- 废气处理高臭氧除臭味杀菌UV光解光氧汞齐灯紫外净化灯管
- DBD的双放电气隙臭氧发生器串联谐振特性
- 常规处理-臭氧活性炭-超滤膜净水工艺的工程应用
- 串联负载谐振式DBD型臭氧发生器电源的基波分析法
- SCALE集成驱动器在臭氧发生器逆变电源中的应用
- 工业给排水相关知识臭氧技术在泳池水处理中的使用
- 工业给排水相关知识臭氧技术在泳池水处理中的用途
- 大型臭氧发生器IGBT逆变电源电路的设计与分析
- 常规处理臭氧活性炭超滤膜净水工艺的工程应用
- ITT处理业务团队签订上海源江水厂臭氧发生器项目
- 南洲水厂深度处理臭氧系统施工组织及施工监理
- 净水厂砂滤池与臭氧活性炭滤池集约化组合的设计
- 净水厂臭氧制备车间的爆炸危险性分析及电气设计
- 频率跟踪型PWM控制的臭氧发生器电源
- 臭氧发生器变频电源设计与分析
- 新型DBD臭氧发生器电源移相控制电路

