

38-13 _ 药品生产质量管理规范认证 发布时间: 2011-04-26 药品生产质量管理规范认证 许可项目名称: 编号: 38-13 法定实施主体: 北京市药品监督管理局 依据: 1、《中华人民共和国药品管理法 》(中华人民共和国主席令第 45 号第九条) 2、《中华人民共和国药品管理法实施条例 》(中华人民共和国国务院令第 360 号第五条至第七条) 3、《药品生产质量管理规范( 1998 年修订) 》(国家药品监督管理局令第 9 号) 4.《药品生产质量管理规范( 2010 年修订)》(中华人民共和国卫生部令第 79 号) 5.《药品生产监督管理办法》(国家食品药品监督管理局令第 14 号 第九条) 6.《药品生产质量管理规范认证管理办法》(国药监安 [2005]437 号 第三条至第二十三条) 7.国家食品药品监督管理局关于印发《药品 GMP 认证检查评定标准》的通知 (国食

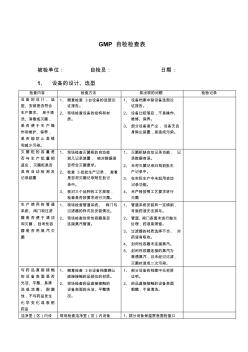
GMP 自检检查表 被检单位: 自检员: 日期: 1、 设备的设计、选型 检查内容 检查方法 易出现的问题 检验记录 设备 的设计 、选 型、安装是否符合 生产要求、 易于清 洗、消毒或灭菌, 是否 便于生 产操 作和维护、保养, 是否 能防止 差错 和减少污染。 1、 随意检查 3台设备的选型论 证报告。 2、 现场检查设备的结构和材 质。 1、 设备档案中缺设备选型论 证报告。 2、 设备比较落后,不易操作、 维修、保养。 3、 部分设备易产尘, 设备无自 身除尘装置,易造成污染。 灭菌 柜的容 量是 否与 生产批 量相 适应,灭菌柜是否 具有 自动检 测及 记录装置 1、 现场检查灭菌柜的自动检 测几记录装置, 核对数据是 否符合灭菌要求。 2、 检查 3批批生产记录, 查看 是否将灭菌记录附在批记 录中。 3、 核对三个品种的工艺规程, 检查是否按要求进行灭菌。 1、 灭菌柜缺自动
热门知识
gmp厂房设计规范-
话题: 装修工程songke2005
精华知识
gmp厂房设计规范-
话题: 暖通空调yangliu1321
-
话题: 工程造价wenjieaaaa
-
话题: 装修工程weichunhai
最新知识
gmp厂房设计规范-
话题: 建筑设计amandadong
- gmp建筑 哪个流派
- gmp建筑
- gmp建筑事务所
- 德国gmp建筑师事务所
- gmp建筑设计事务所
- gmp车间平面图
- 医疗器械gmp厂房设计中介
- gmp厂房设计指南
- gmp洁净室设计
- gmp设计
- 张峰水库供水发电洞洞内埋管及电站厂房明管制安施工
- 中国建筑抗震设计规范的演变与展望
- 优选第五章厂房大门特征门木结构工程建筑工程概预算
- 宜兴抽水蓄能电站地下厂房岩壁梁混凝土温控防裂技术
- 中国水泥工厂余热发电设计规范国家标准即将出台
- 引黄工程北干1~#隧洞Ⅳ标预制厂房钢吊车梁的设计
- 云南省人民政府关于加快工业园区标准厂房建设的意见
- 宜兴抽水蓄能电站地下厂房预应力锚索施工技术
- 制药厂与GMP制药企业洁净厂房百级洁净区作法
- 原油和天然气输送管道穿跨越工程设计规范跨越工程.
- 振动沉管碎石桩加固处理技术在工业厂房施工中的应用
- 厂房设备基础分部分项工程量清单与计价表
- 优秀钢结构厂房施工组织设计方案(技术标)
- 伊朗塔里干水利枢纽地下厂房交通竖井多井滑模与施工
- 中、美混凝土结构设计规范正截面受弯承载力计算对比
- 关于发布国家标准建筑抗震设计规范局部修订公告
- 关于发布国家标准精神专科医院建筑设计规范公告



