- 首页 >
- > 二类医疗器械厂房要求


关于医疗器械生产用洁净厂房建设的要求 《体外诊断试剂生产实施细则(试行)》已实施近两年, 2011 年将实施《无菌和植入 医疗器械生产质量体系管理规范》 ,在日常监管过程中, 发现目前部分企业洁净产房建设不 够规范。为此,现提出洁净厂房的建设要求如下: 一、目前涉及的标准和工作文件 1、YY 0033-2000 无菌医疗器具生产管理规范; 2、YY/T 0567.1-2005 医疗产品的无菌加工 第 1 部分:通用要求; 3、YY/T 0567.2-2005 医疗产品的无菌加工 第 2 部分 过滤; 4、GB 50457-2008 医药工业洁净厂房设计规范; 5、《体外诊断试剂生产实施细则(试行)》中附录 A; 6、《关于印发医疗器械生产质量管理规范无菌医疗器械实施细则和检查评定标准(试 行)的通知》(国食药监械 [2009]835 号); 7、《关于印发医疗器械生产质量管理规范植入性医疗

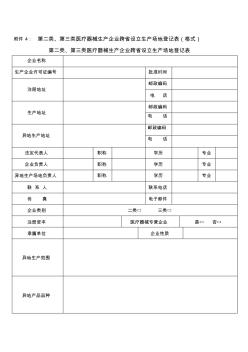
附件 4: 第二类、第三类医疗器械生产企业跨省设立生产场地登记表(格式) 第二类、第三类医疗器械生产企业跨省设立生产场地登记表 企业名称 生产企业许可证编号 批准时间 注册地址 邮政编码 电 话 生产地址 邮政编码 电 话 异地生产地址 邮政编码 电 话 法定代表人 职称 学历 专业 企业负责人 职称 学历 专业 异地生产场地负责人 职称 学历 专业 联 系 人 联系电话 传 真 电子邮件 企业类别 二类□ 三类□ 注册资本 医疗器械专营企业 是□ 否□ 隶属单位 企业性质 异地生产范围 异地产品品种 异地生产场地基本情况 职工总数 技术人员数 异地生产场所 状况(m2) 建设总面积 其 中 生产面积 净化面积 检验面积 仓储面积 检验机构状况 总人数 技术人员数 企业意见 法定代表人签字: 年 月 日 企业盖章: 年 月 日 审核意见 签字: 年 月 日 注册地省级(食 品)药品监督管
热门知识
二类医疗器械厂房要求-
话题: 工程造价mthkl881007
-
话题: 工程造价151****0068
-
话题: 工程造价151****8910
-
话题: 工程造价151****3582
精华知识
二类医疗器械厂房要求-
话题: 工程造价152****5559
最新知识
二类医疗器械厂房要求-
话题: 工程造价151****5758
-
话题: 工程造价152****6966
-
话题: 工程造价150****2829
-
话题: 工程造价150****8518
二类医疗器械厂房要求知识来自于造价通云知平台上百万用户的经验与心得交流。 注册登录 造价通即可以了解到相关二类医疗器械厂房要求最新的精华知识、热门知识、相关问答、行业资讯及精品资料下载。同时,造价通还为您提供材价查询、测算、询价、云造价等建设行业领域优质服务。手机版访问:二类医疗器械厂房要求
- 建筑一类二类如何分
- 什么是二类高层建筑
- 安徽二类办公电气施工图
- 二类高层商住楼什么意思
- 二类高层办公楼土建施工图
- 二类高层办公楼图纸
- 二类高层酒店建筑施工图
- 二类高层办公楼施工图纸
- 二梯四户二类高层户型
- 国家二类排放标准
- 张峰水库供水发电洞洞内埋管及电站厂房明管制安施工
- 优选第五章厂房大门特征门木结构工程建筑工程概预算
- 中华人民共和国水产行业标准玻璃钢渔船建造质量要求
- 宜兴抽水蓄能电站地下厂房岩壁梁混凝土温控防裂技术
- 引黄工程北干1~#隧洞Ⅳ标预制厂房钢吊车梁的设计
- 云南省人民政府关于加快工业园区标准厂房建设的意见
- 宜兴抽水蓄能电站地下厂房预应力锚索施工技术
- 制药厂与GMP制药企业洁净厂房百级洁净区作法
- 有抗震结构设计要求的建筑必须要使用HRBE钢筋吗
- 中国水利报评论:理清全面深化水利改革的思路与要求
- 振动沉管碎石桩加固处理技术在工业厂房施工中的应用
- 厂房设备基础分部分项工程量清单与计价表
- 园林的绿化检验批质量的验收记录簿表格全套要求规范
- 原材料和配件检验项目、质量要求和检验频次内控标准
- 中国华电集团公司防止电力生产事故重点措施补充要求
- 优秀钢结构厂房施工组织设计方案(技术标)
- 异型钢伸缩缝在旧桥改造施工中安装新工艺及技术要求



