

附件 8 第一类医疗器械备案资料要求及说明 一、 申请表 应按照要求完整填写注册申请表。 二、产品风险分析资料 对产品进行安全风险管理相关情况概述 三、产品技术要求 四、产品检验报告 产品全性能自检报告或委托检验报告。 五、临床评价资料 (一)产品预期用途的描述; (二)与产品使用有关的临床风险分析; (三)已上市同类产品临床使用情况的比对说明; (四)其他证明产品安全性、 有效性的研究资料或文献资料。 六、生产制造信息 对生产过程相关情况的概述。 七、产品说明书及最小销售单元的包装、标签设计样稿 八、证明性文件 (一)境内备案人提供:企业法人营业执照副本。 (二)境外备案人提供: 1. 境外备案人所在国家(地区)医疗器械主管部门出具的 允许产品上市销售的证明文件; 2. 境外备案人在中国境内指定代理人的委托书、代理人承 诺书及营业执照副本或者机构登记证明复印件。 九、符合性声明 (一)

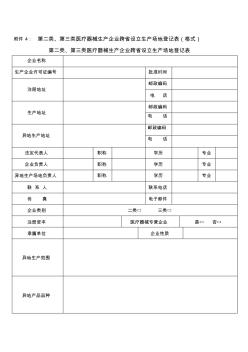
附件 4: 第二类、第三类医疗器械生产企业跨省设立生产场地登记表(格式) 第二类、第三类医疗器械生产企业跨省设立生产场地登记表 企业名称 生产企业许可证编号 批准时间 注册地址 邮政编码 电 话 生产地址 邮政编码 电 话 异地生产地址 邮政编码 电 话 法定代表人 职称 学历 专业 企业负责人 职称 学历 专业 异地生产场地负责人 职称 学历 专业 联 系 人 联系电话 传 真 电子邮件 企业类别 二类□ 三类□ 注册资本 医疗器械专营企业 是□ 否□ 隶属单位 企业性质 异地生产范围 异地产品品种 异地生产场地基本情况 职工总数 技术人员数 异地生产场所 状况(m2) 建设总面积 其 中 生产面积 净化面积 检验面积 仓储面积 检验机构状况 总人数 技术人员数 企业意见 法定代表人签字: 年 月 日 企业盖章: 年 月 日 审核意见 签字: 年 月 日 注册地省级(食 品)药品监督管
热门知识
二类医疗器械备案-
话题: 工程造价151****5758
-
话题: 工程造价151****3582
-
话题: 工程造价152****6966
精华知识
二类医疗器械备案-
话题: 工程造价150****2829
-
话题: 工程造价150****8518
-
话题: 工程造价mthkl881007
最新知识
二类医疗器械备案-
话题: 工程造价151****0068
-
话题: 工程造价151****8910
-
话题: 工程造价152****5559
-
话题: 工程造价158****5938
- 一二类土可以用于回填吗
- 一、二类烟煤的成分和价格
- 工程预算要不要算二类费
- 二类材料价差系数
- 二类场地指的是二类土吗
- 二类取费是什么意思
- 什么是二类材差
- 三类土与一、二类土的选择
- 北京04概算二类取费
- 变配电工程二类费用问题
- 宜昌市工程建设监理企业备案管理办法
- 关于开展政府采购招标业务代理机构登记备案工作通知
- 广州市关于建筑业企业办理在穗登记备案有关事项通知
- 广州市林业和园林绿化工程建设项目招标文件备案申报表
- 关于加强民用建筑工程建筑节能专项验收备案工作通知
- 建筑起重机械备案登记办法(建质[2008]76号)
- 居住建筑工程节能设计审查备案登记表通辽建筑业协会
- 建设工程质量监督管理完善工程竣工验收备案工作
- 建筑工程质量监督管理与竣工验收备案实务全书前言
- 建筑工程质量监督管理与竣工验收备案实务全书目录
- 建设工程材料备案管理建材备案产品品种目录及执行标准
- 广州市办理建设工程竣工验收备案需提交的资料
- 毕节市市外物业服务企业资质核验备案登记表
- 关于加强省外勘察设计企业进鲁承担业务备案管理的意见
- 建筑智能化工程竣工内部验收备案
- 医疗器械生产记录表格
- 晋中市平遥县第三次国土调查作业队伍培训合格人员备案表



