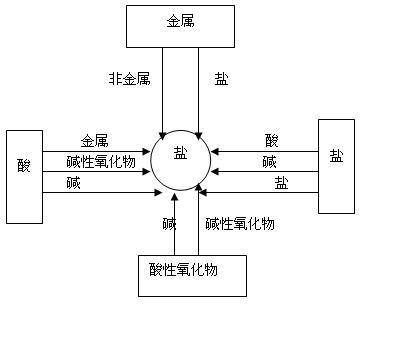
酸碱盐
酸指电离时产生的阳离子全部都是氢离子的化合物;碱指电离时产生的阴离子全部都是氢氧根离子的化合物;盐指电离时生成金属阳离子(或铵根离子)和酸根离子的化合物。可以简记为:氢头酸、氢氧根结尾碱、金属开头酸根结尾的是盐。酸、碱、盐是化学学习中的重要知识点。
酸碱盐基本信息
| 中文名称 | 酸碱盐 | 外文名称 | 酸(acid);碱(base);盐(Salt) |
|---|---|---|---|
| 酸定义 | 氢离子和酸根离子的化合物 | 碱定义 | 金属离子和氢氧根离子的化合物 |
| 盐定义 | 金属离子和酸根离子的化合物 | 本质 | 化学学习中的重要知识点 |
| 特点 | 一定含有非金属元素 | ||
酸
有腐蚀性,溶液呈酸性,能与活泼金属发生反应,碱,某些盐和金属氧化物反应 与排在氢之前的活泼金属反应生成盐和氢气 ,与指示剂反应. pH显酸性的溶液不一定是酸,但是酸一定是酸性溶液(即显酸性)。
碱
有腐蚀性。溶液呈碱性,能与酸,某些盐,非金属氧化物反应 ,某些碱能与某些金属氧化物反应,与指示剂反应 碱性溶液不一定是碱,但是碱一定是碱性溶液.(显碱性的溶液不一定都是碱溶液,即所谓的碱;但碱,一定显碱性,即pH值大于7.)
盐
有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应
还能和其他某些化合物反应
酸碱盐造价信息
酸的性质
(1)酸+碱=盐+水 即:中和反应。
反应条件:无
反应类型:复分解反应
例:H2SO4(酸)+Mg(OH)2(碱)= MgSO4(盐)+ 2H2O(水)
(2)酸+盐=新酸+新盐
反应条件:1.有气体或者水或者沉淀生成才能反应
2.盐必须溶于酸:例如BaSO4、AgCl不能与酸反应,因为它不溶于酸 (初中化学不讨论)
反应类型:复分解反应
例:2HCI(酸)+Na2CO3(盐)= H2CO3(新酸)+ 2NaCl(新盐)
但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了
(3)酸+活泼金属=盐+氢气
反应条件:金属是活泼金属
反应类型:置换反应
例:2HCl(盐酸)+Fe(活泼金属)= FeCl2(盐)+H2↑(氢气)
(4)酸+金属氧化物=盐+水
反应条件:无
反应类型:复分解反应
例:H2SO4(酸)+CuO(碱性氧化物)= CuSO4(盐)+H2O(水)
口诀:钾钠铵盐硝酸盐,全能溶于水中间
盐酸盐不溶银亚汞,硫酸盐不溶钡和铅
碳酸盐类多不溶,易溶只有钾钠铵
碱类能溶钾钠钙钡铵
诸酸多溶解,硅酸不在内
酸的通性
⑴酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
⑵酸能与活泼金属反应生成盐和氢气
⑶酸能与碱性氧化物反应生成盐和水
⑷酸能与碱反应生成盐和水
⑸酸能与某些盐反应生成新的盐和新的酸
碱的性质
(1)碱+酸(见酸的性质)
(2)碱+盐=新碱+新盐
反应条件:碱和盐必须都溶于水,有沉淀生成(二者同时满足)
反应类型:复分解反应 条件:反应有沉淀或有水或有气体生成。(简记:上"↑"、下"↓"、水"H2O)
例:Ca(OH)2(碱)+ K2CO3(盐)= CaCO3↓(新盐)+ 2KOH(新碱)
(3)碱+一些非金属氧化物=盐+水 反应条件:非金属氧化物是酸性氧化物 反应类型:复分解
例:Ca(OH)2(碱)+ CO2(非金属氧化物)= CaCO3↓(盐)+ H2O(水)
此反应用于鉴别CO2。
盐的性质
(1)盐+酸-(见酸的性质)
(2)盐+碱-(见碱的性质)
(3)盐+盐=新盐+新盐
反应条件:盐必须都溶于水,生成物中有沉淀(二者同时满足)
反应类型:复分解
例:BaCl2+Na2SO4=BaSO4↓+2NaCl
这是一个沉淀的反应
(4)盐+某些金属=新盐+新金属
反应条件:盐能溶于水,金属的活动性比盐中的大(二者同时满足)
反应类型:置换
例:CuSO4(盐)+ Fe(金属)=FeSO4(新盐)+ Cu(新金属)
但是有些金属无法实现此反应,即除钾钙钠以外,因为他们和水就反应了
酸性氧化物:
溶于水之后呈酸性的物质(一般是非金属氧化物)
例CO2(二氧化碳)溶于水后是碳酸(H2CO3),碳酸是酸性的,所以CO2是酸性氧化物
碱性氧化物:
同上类似,水合后是碱性的物质(一般是金属氧化物)
例CaO(氧化钙)溶于水后溶液呈碱性,故CaO(氧化钙)是碱性氧化物 关于酸碱盐的反应性质,需要知道什么是可溶物,什么是不溶物
那么有一个口诀:
都溶硝酸钾钠铵 即意为:硝酸,钾,钠,铵的盐都是能溶于水的
碳酸没有三价盐 即意为:一般认为,碳酸盐中的金属离子没有3价的
盐酸除银汞 即意为:银和汞的氯化物不溶于水
硫酸去钡铅 即意为:钡和铅的硫酸盐不溶于水
碱溶有五位 .......
钾钠铵钙钡 即意为(合上句):一般情况碱只有5个能溶于水:钾钠铵钙钡 (钙为微溶)
钾钠铵硝酸盐可溶(含有钾、钠、铵和硝酸根元素的盐可溶于水)
盐酸盐除银铅汞(盐酸盐即是氯,即氯化银、氯化汞、氯化铅不溶)
硫酸钡铅独两种(即硫酸钡、硫酸铅不溶)(钙、银是微溶)
其余大多都不溶(除了上两句提到的,其他的盐大多不溶)
碱类常见溶五种
钾钠钡钙铵可溶(即只有氢氧化钾、氢氧化钠、氢氧化钡、氢氧化铵可溶、氢氧化钙微溶)
不妨请来酚酞试
保证杯杯都变红(酚酞用于检验碱的存在,遇碱从无色变红)
碳酸根、硅酸根、磷酸根溶三种(三种是指钾、钠、铵,即碳酸钾、碳酸钠、碳酸铵、硅酸铵……)
其余都不溶,或微溶(除了钾、钠、铵,其他的都不溶)
盐的化学式:金属开头+酸根结尾(如碳酸钠[Na2CO3])
碱的化学式:金属开头+氢氧根结尾(如氢氧化钠[NaOH])(除[NH3·H2O] 氨水)
酸的化学式:氢元素开头+酸根结尾(如盐酸[HCl]、硝酸[HNO3])
钾钠铵盐都可溶,
硝酸盐遇水影无踪,
氯化物不溶氯化银,(氯化物中,只有氯化银不溶)
硫酸盐不钡钙银微,(硫酸盐中,硫酸钡不溶,硫酸钙、硫酸银微溶)
碱类不溶是多数,
除去钙钡钾钠铵,(氢氧化钙微溶,氨水具有挥发性)
硝酸盐,亚硫酸盐,
溶解只有钾钠铵。
(只适用于初中!)
读法
酸:含氧酸的读法是把氢和氧去掉,剩下什么叫什么酸
例:H2SO4,去掉氢和氧之后剩下硫,所以叫硫酸(HNO3念硝酸除外)
无氧酸的读法是氢某酸
例:HCl,除去氢还剩氯,所以叫做氢氯酸 (也称盐酸)
碱:碱的读法是氢氧化某
例:NaOH,所以叫氢氧化钠
根据化合价的不同,还可以读作:氢氧化亚某
例:Fe(OH)3氢氧化铁,Fe(OH)2氢氧化亚铁
NH3·H2O 氨水特例
盐:
某化某:NaCl,CaCl2,MgCl2 (盐酸盐)
硫酸某:CuSO4,CaSO4,Na2SO4(硫酸盐)
碳酸某:Na2CO3,CaCO3,K2CO3(碳酸盐)
硝酸某:Na2NO3,KNO3,NH4NO3(硝酸盐)
酸碱盐常见问题
-
河南08定额,应该套14-146(管廊钢结构 防锈漆 第一遍)及14-563(KJ-130涂料 一般钢结构 面漆 每一遍)定额子目,将14-146子目中的防锈漆换为H06-9稳定型带绣底漆,将14-5...
-
盐碱地和酸碱地有什么区别我国现存的五大盐碱地按照其盐碱属性可分为两大部分,盐含量过高的地质土壤为盐地,碱含量过高的地质土壤为碱地。盐碱地是盐类集积的一个种类,是指土壤里面所含的盐分影响到作物的正常生长...
-
首先,酸碱盐之间的反应都是复分解反应;复分解反应实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质。这个反应的前提条件都是是离子交换,必须有自由离子才能进行反应。 酸碱中和反应...
在化学上,广义的盐是由阳离子(正电荷离子)与阴离子(负电荷离子)所组成的中性(不带电荷)的离子化合物
⒈和酸发生反应[复分解反应]酸+盐→新盐+新酸(强酸→弱酸)这里的盐可以是不溶性盐。但不能是不溶于酸的盐
[举例]2HCl+Na2CO3=H2O+CO2↑+2NaCl (碳酸H2CO3不稳定会继续分解成水H2O和二氧化碳CO2)
⒉和碱发生反应[复分解反应]碱(可溶)+盐(可溶)→新碱+新盐
[举例]2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
⒊和某些金属反应[置换反应]盐+金属单质(某些)→新金属单质+新盐
反应中的金属一定要比盐中的金属活泼才可以把它给置换出来
[举例]Zn+CuSO4=ZnSO4+Cu (有一个金属活泼性顺序表,活泼性依次减弱:钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金。在这个实例中,锌(Zn)的活泼性在铜(Cu)之前,所以可以把铜置换出来)。
盐也分为正盐,酸式盐,中性盐,碱式盐,复盐。
正盐:单由金属离子(包括铵根离子)和酸根离子构成
酸式盐:由金属离子(包括铵根离子)、氢离子 酸根离子和非金属离子构成
碱式盐:由金属离子(包括铵根离子)、氢氧根离子 酸根离子和非金属离子构成
复盐:由不同金属离子(包括铵根离子)和酸根离子构成
碱式盐详细解释 电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或铵根)的盐。
酸跟碱反应时,弱碱中的氢氧根离子部分被中和,生成的盐为碱式盐。碱式盐,二元碱或多元碱才有可能形成碱式盐。碱式盐的组成及性质复杂多样。碱式碳酸铜(也称铜绿,铜生锈后产生的物质)[Cu2(OH)2CO3]和碱式氯化镁[Mg(OH)Cl]等都属于碱式盐。
碱式盐是碱被酸部分中和的产物。
盐的种类
关于盐呈酸性碱性的口诀:"谁强显谁性"
比如强酸弱碱盐显酸性,强碱弱酸盐显碱性,
但如果是强酸强碱盐或弱酸弱碱盐就显中性。
说明:强酸性的物质(或化合根)有: Cl (氯) (硝酸根) (硫酸根)等
弱酸性的物质(或化合根)有: (碳酸根)等
强碱类的物质(或化合根)有:Na(钠)、K(钾)等
弱碱类的物质(或化合根)有:NH4 (铵根)、Cu(铜)等
强酸强碱盐:中性(pH=7)(如:NaCl, KNO3)
强酸弱碱盐:酸性(pH<7)(如:NH4Cl,CuSO4)
弱酸强碱盐:碱性(pH>7)(如:Na2CO3)
⒈氯化钠晶体不能导电,是因为氯化钠晶体中不存在带有电荷的微粒,这句话对吗?
不对,因为氯化钠是典型的离子化合物,其中含有钠离子和氯离子,但由于阴、阳离子的静电作用,氯化钠晶体中的和按一定规则紧密地排列着,只能在一定振幅范围内振动,不存在可以自由移动的离子。所以,干燥的氯化钠不导电是因为其中的带电微粒(即阴、阳离子)不能自由移动。
⒉ 氯化氢溶于水可电离产生,故氯化氢属于离子化合物,对吗?
不对,氯化氢是典型的共价化合物,它是由氯化氢分子构成。在氯化氢分子中氢原子和氯原子以一对共用电子对结合在一起,由于氯原子的得电子能力强于氢原子,所以共用电子对偏向氯原子,偏离氢原子。当氯化氢溶于水时,由于水分子的作用使该共用电子对完全由氯原子享用,即相当于氯原子完全获得了一个电子,形成了氯离子,氢原子完全失去唯一的电子,形成了氢离子。类似的离子如硫酸,它属于共价化合物,但溶于水后可电离产生。
⒊ 酸溶液与酸性溶液是不是一回事?
酸溶液是酸的水溶液,它显酸性,溶液中的阳离子只有氢离子。酸性溶液是显酸性的溶液,溶液中也有氢离子,但阳离子不一定只有氢离子,因此酸性溶液不一定是酸溶液,例如溶于水时,电离产生的阳离子除了氢离子外还有钠离子,所以也表现出酸性,可使石蕊溶液变红色。但只是呈酸性的溶液,不一定是酸溶液。
⒋ 只要在反应中能生成盐和水,则该反应一定是中和反应,对吗?
不对,因为中和反应是特指酸和碱之间发生的反应,它属于复分解反应,而反应中能生成盐和水,未必一定是复分解反应。如就不是复分解反应,那更谈不上中和反应,即使是生成盐和水的复分解反应也未必是中和反应,如,虽然能生成盐和水,但由于反应物不是酸与碱,所以不是中和反应。
⒌ 碱性氧化物一定是金属氧化物,此话对吗?
碱性氧化物是指能与酸起反应生成盐和水的氧化物,大多数金属氧化物是碱性氧化物,可以说碱性氧化物一定是金属氧化物,但不能说金属氧化物一定是碱性氧化物,如是金属氧化物但不是碱性氧化物。
⒍ 怎样保存氢氧化钠和氢氧化钙?怎样检验久置的氢氧化钠、氢氧化钙是否变质?
固体氢氧化钠吸湿性特强,易吸收空气中的水分而潮解;还能跟空气中的二氧化碳起反应生成碳酸钠而变质;氢氧化钙虽不像氢氧化钠那样潮解,但也有吸湿性,同时也容易与空气中的二氧化碳反应生成碳酸钙,所以氢氧化钠、氢氧化钙都必须密封保存。
不仅固态的氢氧化钠、氢氧化钙需密封保存,而且它们的水溶液由于容易吸收空气中的二氧化碳也必须密封保存。
久置的氢氧化钠、氢氧化钙,往往因吸收了空气中的二氧化碳,部分变质为碳酸钠、碳酸钙,要检验它们是否变质,只要加足量稀盐酸即可,如果有气体产生表示已变质,否则未变质。
⒎ 结晶水合物中通常含有两种或多种微粒。那么硫酸铜晶体究竟是纯净物还是混合物?
判断纯净物与混合物的依据是看该物质的组成(或构成)是否固定,而不是看该物质中所含微粒的种数。硫酸铜晶体的化学式为(CuSO4·5H2O),即该晶体中微粒与分子之间的个数比是固定的,为1:5,所以硫酸铜晶体中各元素之间的质量比是固定的,由此可知硫酸铜晶体是纯净物。类似的碳酸钠晶体也是纯净物。
⒏ 碳酸钠属于盐,为什么其水溶液呈碱性?
碳酸钠溶于水后电离产生,和水分子发生如下反应:,溶液中产生一定量的离子,所以溶液显碱性,如果给碳酸钠溶液加热,可产生更多的,使溶液的碱性更强。
⒐ 为什么硝酸钾、硝酸钠、硫酸钡等物质一般不与其他物质发生复分解反应。
物质间发生复分解反应必须满足复分解反应发生的条件,即生成物中必须有水或气体或沉淀,硝酸钾是盐,盐能与酸、碱、盐起反应,分别生成新酸、新碱与新盐,但硝酸钾与酸、碱、盐反应后所生成的新酸是硝酸,生成的新碱是氢氧化钾,生成的新盐必定是硝酸盐或钾盐,其中既无气体也没有沉淀,而反应又不生成水,不具备复分解反应发生时对生成物的必要条件,同理,硝酸钠一般也不发生复分解反应。
根据复分解反应进行的条件,反应物必须可溶于水或酸,而硫酸钡既不溶于水又不溶于酸,所以硫酸钡不可能发生复分解反应。
⒑ 鉴别氯离子和硫酸根离子时,除了加溶液、溶液外,为什么还要加稀硝酸?以钠盐为例说明。
强碱,强酸,弱酸,弱碱
在含有氯离子或硫酸根离子的溶液鉴别反应中,必须加入稀硝酸以排除其它离子的干扰,如碳酸根离子,亚硫酸根离子等。
酸----在水溶液中电离出的阳离子全部是氢离子的化合物。所谓强酸、弱酸是相对而言,
----酸溶于水能发生完全电离的,属于强酸。如HCl、H2SO4、HNO3、HBr、HI、
----酸溶于水不能发生完全电离的,属于弱酸。如碳酸、H2S、HCN、HF、磷酸、甲酸(HCOOH)、乙酸、等。
碱----在水溶液中电离出的阴离子全部是氢氧根离子的化合物。所谓强碱、弱碱是相对而言,
----碱溶于水能发生完全电离的,属于强碱。如KOH、NaOH、Ba(OH)2、Ca(OH)2、---活泼的金属对应的碱一般是强碱。
----碱溶于水不能发生完全电离的,属于弱碱。如一水和氨、氢氧化镁(中强碱)、氢氧化铝、氢氧化锌等。
⒒酸或碱加水,溶液是否可以由酸变碱,由碱变酸?
不可以,加水只可稀释溶液,使其酸性或碱性的的程度降低,不会使其由酸变碱,由碱变酸。
改变土壤PH
在土壤里,由于有机物在分解的过程中会生成有机酸,矿物的风化也可能产生酸性物质,空气污染造成酸雨,也会导致一些地方的土壤呈酸性,这些都不利于作物的生长。施用适量的碱,能中和土壤里的酸性物质,使土壤适合作物生长,并促进微生物的繁殖。土壤中的钙离子增加后,能促使土壤胶体凝结,有利于形成团粒,同时又可供给植物生长所需的钙元素。
处理废水
工厂里的废水常呈现酸性或碱性,若直接排放将会造成水污染,所以需进行一系列的处理。碱性污水需用酸来中和,酸性污水需用碱来中和,如硫酸厂的污水中含有硫酸等杂质,可以用熟石灰来进行中和处理。生成硫酸钙沉淀和水。
医药卫生
⑴ 人的胃液呈酸性,当胃液的PH值为0.9~1.5时,有助于食物消化.如果胃酸过多就会使人感到不适,这时医生就会让你口服一些碱性药物,使碱与胃酸反应生成无毒的中性物质,以除去过多的胃酸。如用含有氢氧化铝的药片治疗胃酸过多,生成氯化铝和水。但是因为铝对于脑细胞有抑制作用,现在已经很少使用。
⑵人被有些蚊虫叮咬后,蚁虫在人的皮肤内分泌出蚁酸,使叮咬处很快肿成大包而痛痒。可在患处涂含有碱性物质(如NH3·H2O)的药水来减轻痛痒。 例如肥皂水等。
调节溶液PH
在科学实验室里,经常要把溶液的PH控制在一定范围内,如果溶液的酸性或碱性太强或太弱,就可以用适当的碱或酸调节溶液的PH。
⑴金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
⑵金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
⑶碱性氧化物 +酸 -------- 盐 + 水
⑷酸性氧化物 +碱 -------- 盐 + 水
1.苛性钠(强碱)暴露在空气中变质:2NaOH + CO2 ====Na2CO3 + H2O
2.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
3.苛性钠吸收三氧化硫气体:2NaOH + SO3====Na2SO4 + H2O
4.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
⑸酸 + 碱 -------- 盐 + 水
1.盐酸和烧碱反应:HCl + NaOH ==== NaCl +H2O
2.硫酸与氢氧化钠反应:2NaOH+H2SO4===Na2So4+2H2O
3.酸和氢氧化铜反应:2HCl + Cu(OH)2==== CuCl2 + 2H2O
⑹酸 + 盐 -------- 另一种酸 + 另一种盐
1.大理石与稀盐酸反应:CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
2.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
3.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
4.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO3
⑺碱 + 盐 -------- 另一种碱 + 另一种盐
1.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH)2↓ + Na2SO4
2.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
3.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
氯离子:银盐(除氯化银)
硫酸根离子:钡盐(除硫酸钡)
铵根离子:碱(任意)
氢氧根离子:铵根(NH+)
氢离子:碳酸盐和澄清石灰水 碱
碳酸根离子:酸(除碳酸),钙盐,钡盐(除碳酸钙和碳酸钡)
铁离子:2价铁离子是浅绿色,3价是黄色(指溶液)
注:Fe(OH)3溶液为红褐色。(Fe(OH)2没有溶液,该物质为白色沉淀。) 遇到O2会被迅速氧化为灰绿色,最终变为红褐色!
铜离子:2价铜离子是蓝色(指溶液) (无水硫酸铜为白色)
故CaO是碱性氧化物
英文:neutralization reaction
是酸和碱互相交换阴阳离子成分(其中酸根算作一个整体),生成盐和水的反应,并放出热量。
(中和反应属于复分解反应)
中和反应的实质是:H+和OH-结合生成水(H2O)。
酸+碱→盐+水 例如HCl+NaOH=NaCl+H2O
(注意:有盐和水生成的反应,不一定是中和反应
如:2NaOH+CO2= Na2CO3+H2O)
所以只要酸碱发生了反应就叫中和,不管进行到何种程度。
判断是否完全中和是以酸碱是否恰好完全反应作为标准的。
在酸碱滴定中的理论值和实际值总有相差,来看看这个:
酸碱滴定中三个重要的点:
当量点:酸的当量数=碱的当量数(二者正好完全反应)
终点:指示剂变色的点.
中和点:酸碱滴定过程中,容易恰成中性的点. 即pH=7
注意:(当量点才是恰好完全反应的点)
当量点不一定等于终点.
当量点不一定等于中性.
当量点无法直接观察到,滴定时酸碱的强弱不同,达到滴定终点时溶液的酸碱性就不同,需选择适当指示剂使终点等于当量点,以作为判断标准.
指示剂的选择:
①强酸与强碱的中和滴定
当量点溶液的pH=7,这时既可选酚酞做指示剂,也可选甲基橙做指示剂.一般不用紫色石蕊试液做指示剂,因其颜色突变不明显.
②强酸与弱碱的中和滴定
当量点溶液显酸性,溶液pH<7,最好选甲基橙、甲基红做指示剂,一般不选酚酞试液做指示剂.因为酚酞溶液遇酸不变色。
③弱酸与强碱的中和滴定
当量点溶液显碱性,pH>7,这时最好选酚酞做指示剂,一般不选甲基红和甲基橙做指示剂.
酸碱反应产生热量:
强酸强碱反应,1mol氢离子与1mol氢氧根离子反应,△H=-57.3KJ
酸碱盐文献

 中考化学知识点过关培优训练∶金属及酸碱盐反应的图像含详细答案
中考化学知识点过关培优训练∶金属及酸碱盐反应的图像含详细答案
中考化学知识点过关培优训练∶金属及酸碱盐反应的图像含详细答案

 耐腐蚀防酸碱地面
耐腐蚀防酸碱地面
耐腐蚀防酸碱地面 一、 PVFE耐酸碱地面 二、耐油、耐酸碱防滑地砖 三、耐酸碱环氧地坪漆 PVFE耐酸碱地面 耐油、耐酸碱防滑地砖 耐酸碱环氧地坪漆 耐酸碱环氧地坪 耐酸碱地坪漆为三组份漆 ,适合防腐罐、重型机械表面处理及化工企业易腐蚀区域 的地坪,石油工业的防腐工程及污水池化学池等。抗渗透性强,耐强酸、碱、盐 及各种有机溶剂,表面硬度高,致密性好。 耐酸碱地坪漆特性: 可经受叉车、卡车长期碾压,使地面重度耐腐蚀、耐强酸碱、耐化学溶剂、耐冲 击、防地面龟裂。适用范围:电镀厂、电池厂、化工厂、电解池、制药厂、酸碱 中和池等场所的地面、墙面及设备表面。 施工工艺: 1、地面处理 : 依据地面状况做好打磨、修补、除污、除尘; 2、环氧底漆:采用渗透性及附着力特强底漆滚涂一道,增强表面附着力; 3、玻纤铺设:用玻纤布全面铺设一道; 4、环氧砂浆:将环氧双组份加入石英砂,用镘刀将其均
在常见的酸中,除硅酸、原硅酸不溶于水,石炭酸在常温下微溶于水外,其余的都易溶于水。
在常见的碱中,除一水合氨(只存在于溶液中)、钾、钠、钡的氢氧化物易溶于水,氢氧化钙微溶于水外,大多数难溶于水。
在常见的盐中,钾盐、钠盐、铵盐、硝酸盐一般易溶于水;盐酸盐除氯化亚汞微溶于水、氯化银难溶于水外,其余易溶于水;硫酸盐除硫酸钙、硫酸银微溶于水,硫酸钡难溶于水外,其余的易溶于水;碳酸的正盐、硅酸的正盐、亚硫酸的正盐、磷酸的正盐、氢硫酸的正盐除钾盐钠盐铵盐易溶于水外,其余的难溶于水。
为了便于记忆,可用下列歌诀概括上时主要内容:
碱有钾钠钡钙镁,后两种逐渐不溶于水;
盐酸盐不溶氯化银,还有亚汞盐步后尘;
硫酸盐微溶银和钙,还有硫酸钡在后面;
后五种,较特别,只有钾钠铵盐溶。
另外,还要掌握:
磷酸二氢盐一般易溶于水,磷酸氢盐和正盐类似,一般不溶于水;碳酸氢盐一般易溶于水。
碳酸钠比碳酸氢钠更易溶于水,而碳酸氢钙易溶入水,碳酸钙难溶于水;
硫酸钡、氯化银、硫化铜、硫化银、硫化铅既不溶于水,也不溶于酸。
酸碱盐总结分类
酸
按酸根可分为(1)含氧酸(HNO3. H2SO4等)(2)无氧酸(HCL. HI等)
按电离出的H+数可分(1)一元酸(HCL. HI等)(2)二元酸(H2SO4. H2CO3等)(3)多元酸(H3P04等)
按强弱(1)强酸(HCL. H2SO4等)(2)弱酸(H2CO3等)
碱
按强弱(1)强碱(NAOH. KOH等)(2)弱碱(FE(OH)3 等)
按电离出的OH-数(1)一元碱(NAOH. KOH 等) (2)二元碱(Ba(OH)2 . Ca(OH)2等)(3)多元碱(Fe(OH)3等)
盐
(1)正盐(Na2CO3. Na2SO4等) (2)酸式盐(NaHC03. NaHSO4等)(3)碱式盐(Cu2(OH)2CO3等
OH(-) | NO3(-) | Cl(-) | SO4(2-) | CO3(2-) | PO4(3-) | |
H(+) | --- | 溶、挥 (HNO3) | 溶、挥 (HCl) | 溶 (H2SO4) | 溶、挥 (H2CO3) | 溶 |
K(+) | 溶(KOH) | 溶(KNO3) | 溶(KCl) | 溶(K2SO4) | 溶(K2CO3) | 溶 |
Na(+) | 溶(NaOH) | 溶(NaNO3) | 溶(NaCl) | 溶(Na2SO4) | 溶(Na2CO3) | 溶 |
NH4(+) | 溶、挥(NH3·H2O) | 溶(NH4NO3) | 溶(NH4Cl) | 溶(NH4)2SO4 | 溶(NH4)2CO3 | 溶 |
Ba(2+) | 溶Ba(OH)2 | 溶Ba(NO3)2 | 溶BaCl2 | 不(BaSO4) | 不(BaCO3) | 不 |
Ca(2+) | 微Ca(OH)2 | 溶Ca(NO3)2 | 溶(CaCl2) | 微(CaSO4) | 不(CaCO3) | 不 |
Mg(2+) | 不Mg(OH)2 | 溶Mg(NO3)2 | 溶(MgCl2) | 溶(MgSO4) | 微(MgCO3) | 不 |
Al(3+) | 不Al(OH)3 | 溶Al(NO3)3 | 溶(AlCl3) | 溶Al2(SO4)3 | --- | 不 |
Mn(2+) | 不Mn(OH)2 | 溶Mn(NO3)2 | 溶(MnCl2) | 溶(MnSO4) | 不(MnCO3) | 不 |
Zn(2+) | 不Zn(OH)2 | 溶Zn(NO3)2 | 溶(ZnCl2) | 溶(ZnSO4) | 不(ZnCO3) | 不 |
Fe(2+) | 不Fe(OH)2 | 溶Fe(NO3)2 | 溶(FeCl2) | 溶(FeSO4) | 不(FeCO3) | 不 |
Fe(3+) | 不Fe(OH)3 | 溶Fe(NO3)3 | 溶(FeCl3) | 溶Fe2(SO4)3 | --- | 不 |
Cu(2+) | 不Cu(OH)2 | 溶Cu(NO3)2 | 溶(CuCl2) | 溶(CuSO4) | --- | 不 |
Ag(+) | --- | 溶(AgNO3) | 不(AgCl) | 微(Ag2SO4) | 不(Ag2CO3) | 不 |
说明:此为20℃时的情况。"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,"---"表示那种物质不存在或遇到水就分解了
- 相关百科
- 相关知识
- 相关专栏
- 壁挂式太阳能热水器
- 太阳能热水器控制器
- 铜矿
- 太阳能工程联箱
- 太阳能热利用
- 太阳房
- 双乙酸钠
- 屋面防水设计与施工
- 甲基二硫代氨基甲酸钠
- 太阳能建筑
- 从零起步轻松学太阳能热水器养护与修理问答
- 阳台壁挂太阳能
- 碘乙酸钠
- 二甲基二硫代氨基甲酸钠
- 太阳热能
- 环境标志产品技术要求
- 应用VE进行盐田技术改造
- 利用钻井液盐分浓度变化对水溶性天然气矿床评价方法
- 快硬硫铝酸盐水泥配制商品混凝土在大体积工程中应用
- 利用含钴、镍氢化硅酸盐提高橡胶镀铜钢丝粘合作用
- 氯盐阻锈型防冻剂中引气组分掺量对混凝土性能影响
- 吉林省西部土地开发整理重大工程与苏打盐碱土工程改良
- 刘家峡盐锅峡八盘峡三座水电站主要工程技术问题
- 黄河三角洲地区盐渍化土壤整治工程施工进度
- GB/T2015-2005白色硅酸盐水泥之白度测定
- 江苏省造价工程师土建计量铝酸盐水泥考试试卷
- 中南大学土木工程材料掺混合材的硅酸盐水泥
- 京新国家高速甘肃段公路工程区盐渍土分布规律与特征浅析
- 钡渣与炉渣、石灰脚料混掺生产复合硅酸盐水泥的试验
- 江苏省盐城市稳步推进创建发展散装水泥示范乡镇工作
- 江苏省宿淮盐高速公路清浦绕城段绿色通道建设现状与分析
- 复合外加剂生产高掺量液态渣沸腾炉渣复合硅酸盐水泥