气体比热容介绍
描述气体同外界交换热量时,体系温度变化特性的物理量。计算由N个同类分子组成的理想气体系统的比热容,通常先求出玻耳兹曼统计中分子的配分函数q:然后将系统内能在体积V保持不变的情况下对温度T求导得出定容热容: 若将式中N换成阿伏伽德罗数,就得出定容摩尔热容,亦称定容摩尔比热容。
对理想气体,根据热力学公式即可求得定压热容CP0。
分子由原子组成,原子由原子核和核外电子组成,配分函数的分子能级εi中应包含这些组成因素。原子核由于自旋方位不同的各态之间能量差,在产生原子光谱中是一种超精细结构,且核自旋同电子壳层的相互作用极其微弱,所以其影响在热力学过程中一般可以忽略。电子则由于所处的最低能级同最邻近的次高能级之差远比nT为大,激发它很困难,当温度改变时,它仍处在基态,对于热容就没有贡献。在不考虑具有核衰变的原子的情况下,配分函数公式中的εi只有分子作为整体的质心平动、整体的转动和内部原子间的相对振动这三部分的能量。①平动部分。平动能级的相对间距微不足道,分子作热运动时总可看作是连续的,所以平动部分对热容的贡献可用能量均分定理来处理。分子的平动自由度对定容热容的贡献是而定容摩尔比热容是(以下均指定容摩尔比热容),R是摩尔气体常数。②转动部分。组成多原子分子的原子愈重或数量愈多,转动惯量就愈大,转动的量子效应也就愈显现不出来。一般只考虑低温下较轻双原子分子气体转动的量子性;其他多原子分子或重原子的双原子分子一般可作经典处理。③振动部分。绝大多数的多原子分子在常温下振动能级间距比热运动能量kT大得多,也不容易激发它参与热运动,所以对比热容也没有贡献;只有在高温时才有贡献;温度再高时可作经典处理。事实上,多于两个原子组成的气体分子几乎都不可能达到经典处理时的温度,因为这时多原子分子已经分解了。
气体比热容造价信息
用能量均分定理计算定容摩尔比热容。若分子由N个原子组成,就有3N个自由度,其中质心平动自由度有3个,平动能ε有三个二次方项,对摩尔比热容的贡献为。线型分子有两个转动自由度,转动能ε转有两个二次方项,对摩尔比热容的贡献为R;非线型分子有三个转动自由度,总可以找到三个主转动惯量轴,使转动能ε转有三个二次方项,所以对摩尔比热容的贡献为。剩下的3N-5或3N-6个是振动自由度,总可找到一种简正坐标,使振动能ε振具有3N-5或3N-6个二次方项,于是分子内部诸原子的相对振动自由度对摩尔比热容的贡献为:线型分子是(3N-5)R,非线型分子是(3N-6)R。
在经典处理不适用时,就要计算配分函数q。若平、转、振三部分自由度是互相独立的,则可写为εi=ε ε转 ε振,从而内能是各部分内能相加,也就可以分别地用定容热容公式求对摩尔比热容的贡献。 ①转动部分。因一般只考虑双原子分子情形。对不同原子的双原子分子有2j 1是动量矩不同取向的简并度;是分子的转动惯量,是折合质量,ro是两个原子核之间的平衡距离。令θ转称为转动特征温度,可以用它来区别用经典的还是用量子的方法处理转动问题。当Tθ转时(在常温范围内已满足这条件),量子效应不起作用,q转公式的求和可代之以积分,结果得q转=T/θ转和Cv转=R,这正是能量均分定理所得的结果。当Tθ转时可得随T减小而Cv转→0。由θ转的公式还可看出,转动惯量越大的分子,θ转越小,就不容易显现量子效应。图1中,Cv转在时有一个极大值,然后渐近地趋向于经典值。
对于同核双原子分子,例如氢分子,则必须考虑微观粒子的全同性质对转动状态的影响。两个原子核的自旋平行或反平行的状态不同,贡献的摩尔比热容是不同的。但在高温时仍同经典结果一致;在低温时,则同单原子气体行为一样:Cv转=0。
② 振动部分。由于原子之间通过化学键耦合得很强,所以内部原子的相对振动不属于哪一个原子,而是N个原子集体的振动模式,故有3N-5或3N-6个自由度,也就有那么多的简正振动。每一种简正振动α(α=1,2,...,3N-5或3N-6)有它自己的振动频率vα,若某些频率一样,则频率是简并的。在简谐近似下,简正振动都是独立的,所以振动能量就是各个振动能量之和:
nα是属于简正振动α的振动量子数(nα=0,1,2,...),而配分函数从而求得摩尔比热容对于双原子分子气体,只有一个振动自由度(vα=v)。同样引入振动特征温度则在T>>θ时,Cv=R,同经典结果一样而在Tθ时,可得,随着温度的降低而Cv振→0。图2描绘了双原子分子气体Cv振/R依赖于T/θ振的关系。 对于非理想气体,则由于分子之间存在相互作用,摩尔比热容还与气体浓度和相互作用势的形式有关。
气体比热容介绍常见问题
气体比热容介绍文献

 空气比热容比的测量实验报告
空气比热容比的测量实验报告
空气比热容比的测量实验报告

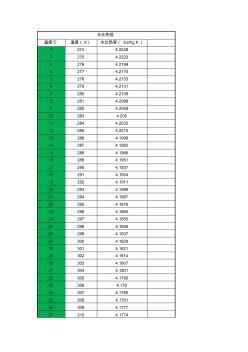 不同温度下水比热容
不同温度下水比热容
水比热容 温度℃ 温度( K) 水比热容( KJ/Kg.K) 1 274 4.2248 2 275 4.2223 3 276 4.2199 4 277 4.2175 5 278 4.2153 6 279 4.2131 7 280 4.2109 8 281 4.2089 9 282 4.2069 10 283 4.205 11 284 4.2032 12 285 4.2015 13 286 4.1998 14 287 4.1982 15 288 4.1966 16 289 4.1951 17 290 4.1937 18 291 4.1924 19 292 4.1911 20 293 4.1899 21 294 4.1887 22 295 4.1876 23 296 4.1865 24 297 4.1855 25 298 4.1846 26 2
定压比热容是指将1 Kg气体在压力不变时,温度升高或降低1℃(1k)时,工质吸收或放出的热量。
定压比热容和定容比热容的定义式都适用于一切工质。
由于气体翟定压下受热要膨胀,所吸热量在使热力学能增加的同时,还要克服外力做功,因而定压比热容大于定容比热容,其差值就是使1 Kg气体在定压下升温的过程中对外所做的喷张工。
定压比热容过程可以理解为两个假想的分过程,即首先使1 Kg气体在定容的情况下升温dT,此时工质的吸热量为
显然有下式成立
另外,
比热容比指的是定压比热Cp与定容比热Cv之比,通常用符号γ表示,即γ=Cp/Cv,是描述气体热力学性质的一个重要参数。
定容比热容计算对象为气体。因为气体在压强不变的条件下,当温度升高时,气体一定要膨胀而对外作功,除升温所需热量外,还需要一部分热量来补偿气体对外所作的功,因此,气体的定压比热容比定容比热容要大些。由于固体和液体在没有物态变化的情况下,外界供给的热量是用来改变温度的,其本身体积变化不大,所以固体与液体的定压比热容和定容比热容的差别也不太大。因此也就不需要区别了。
- 相关百科
- 相关知识
- 相关专栏
- 气体污染物
- 气体洗涤系统
- 气体活化法
- 气体活塞压力计
- 气体流量测量系统
- 气体流量计量管理系统
- 气体浓度检测装置及检测方法
- 气体深冷分离操作指南
- 气体渗透性
- 气体湿度测定仪
- 气体灭火剂的毒性试验和评价方法
- 气体灭火系统施工及验收规范
- 气体灭火系统浸渍时间
- 气体灭火系统设计规范
- 气体热动力润滑与密封
- 气体燃料缸内预混燃烧火焰稳定性的基础研究
- 基于压电堆驱动器的喷嘴挡板式气体控制阀
- 张家港市旺达工业气体有限公司企业信用报告-天眼查
- 以色列CQM-换热器自动清洗装置ATCS技术介绍
- 中国火电之五大发电集团地方电厂及所属公司详细介绍
- 公伯峡发电厂房尾水砼悬空带状牛腿梁施工支撑方案介绍
- 广州新白云国际机场旅客航站楼钢结构安装综合技术介绍
- 基于C8051F350单片机气体流量计检测仪设计
- 机械工程仪器学中可编程逻辑控制器介绍
- 合肥市渡江战役纪念馆弱电系统设计施工含气体灭火工程
- 柜式七氟丙烷气体灭火系统安装与施工方案分析-共7页
- 柜式七氟丙烷气体灭火系统安装与工程施工设计方案模板
- 交换机基础功能介绍
- 介绍造纸中段污水处理节能新设备鼓风式潜水曝气机
- 介绍一种新型空调器冷凝器利用冷凝水提高能效比
- 介绍一种新型沉排沙垫式软体排设计和施工工艺
- 国电酒泉热电厂二氧化碳气体消防工程施工项目组织设计